Das „Bauchfett“ des Herzens
Ektope Fettverteilung-- Fett ist nicht gleich Fett. Neben Menge und Funktionalität ist auch die Fettverteilung bedeutsam für das kardiovaskuläre Risiko. Dabei lohnt ein besonderer Blick auf das sog. epikardiale Fettgewebe – gewissermaßen die Manifestation des Bauchfetts im Herzen.
Veröffentlicht:
Viszerales Fett kann auch als epikardiales Fett das Koronarrisiko mit beeinflussen.
© Juan Gaertner / Science Photo Library / mauritius images
Zahlreiche klinische und pathogenetisch orientierte Studien haben unser Verständnis über das Fettgewebe dergestalt verändert, dass die Menge des Fettgewebes nicht allein das wesentliche pathophysiologische Phänomen ist, sondern insbesondere die abnorme Ablagerung von Fett in anderen Zellen oder Organen, genannt ektope Lipidakkumulation [1–3]. Mediatoren für das erhöhte kardiovaskuläre Risiko und die Insulinresistenz sind hierbei humorale, inflammatorische und metabolische Faktoren, die u. a. durch veränderte Fettzellen, z. B. viszerale Fettzellen, freigesetzt werden [1, 2].

Dr. Paul Balfanz Universitätsklinikum Aachen
© Balfanz
In Abb. 1 ist dieses Konzept schematisch dargestellt. In einer sog. Mendelian Randomisierungs-Studie hat man kürzlich 220 genetische Varianten, die mit der Masse an viszeralem Fett (VAT) assoziiert sind, untersucht. Diese genomweite Assoziationsstudie der UK Biobank bestärkte die klinische Evidenz, dass die Menge an genetisch bedingtem VAT mit einem erhöhten Risiko für koronare Herzkrankheit, Herzinfarkt wie auch Herzinsuffizienz assoziiert ist [4].
Epikardiales Fettgewebe als Bauchfett des Herzens
Epikardiales Fettgewebe (EAT) ist eine Manifestation des VAT am Herzen. Lokalisiert ist es zwischen dem Myokard und viszeralem Perikard [5, 6]. Das EAT weist als Besonderheit keine anatomische Barriere mit dem Myokard auf, sodass sich beide eine Mikrozirkulation teilen [7, 8]. Diese Art von Fettgewebe macht 20 % der Herzmasse aus [6].
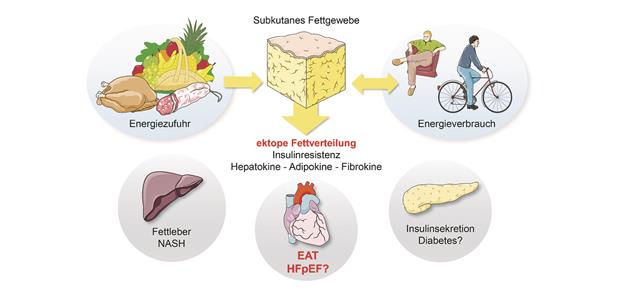
Abb. 1-- Ektope Fettakkumulation als Schnittstelle zwischen Fettgewebe, Energiehaushalt, Insulinresistenz und kardiovaskulärem Risiko. Ektope Ablagerung von Fett in anderen Zellen außer Fettzellen, z. B. in Zellen der Leber (Fettleber) oder der Herzmuskulatur usw., entsteht, wenn die Speicherkapazität des Fettgewebes für die zugeführte Energie nicht ausreicht. Dann kommt es zu einem sog. „Überlaufen“ oder „Overflow“ von Fett in die anderen Organe. Die Menge von ektopem Fett korreliert im Gegensatz zur Menge des subkutanen Fetts mit einer Insulinresistenz. Eine sog. viszerale Fettverteilung intraabdominell und epikardial können aufgrund ihrer anatomischen Lage und ihres Stoffwechsels bzw. ihrer endokrinen (Adipokine) und inflammatorischen Aktivität direkt das Koronarrisiko und die Herzfunktion (z. B. HFpEF) mit beeinträchtigen.
© Balfanz
Es besteht eine starke unabhängige Korrelation zwischen EAT insgesamt und dem Taillenumfang, dem diastolischen Blutdruck und dem Nüchterninsulinwert, d. h. für Indikatoren des metabolischen Syndroms [8, 9]. Das EAT könnte sowohl eine Bedeutung für die Koronarsklerose als auch für die Herzfunktion haben. Eine wachsende Zahl an Studien zeigt, dass epikardiale Fettzellen möglicherweise durch Freisetzung von humoralen, inflammatorischen und metabolischen Mediatoren die Herzfunktion und das kardiovaskuläre Risiko beeinflussen können [10, 11].
EAT und Prädiktion für Ischämie
Es besteht eine positive Korrelation des epikardialen Fettgewebes mit der Kalzifizierung der Koronarien sowie der Prävalenz und dem Progress einer KHK [5, 12, 13]. Auf der Grundlage kardialer CT-Untersuchungen wird postuliert, dass der Anteil an EAT als unabhängiger Ischämieprädiktor dem Calcium-Score überlegen ist. Es konnte zudem gezeigt werden, dass ein Anstieg des EAT-Anteils um 15 % und eine begleitende Hypertonie als unabhängige Prädiktoren mit neuen kalzifizierten Plaques assoziiert sind [13].
EAT und HFpEF
Darüber hinaus geht das Vorhandensein von epikardialem Fett mit einer Modulation der diastolischen Herzfunktion und einer ungünstigen Prognose für die Herzinsuffizienz einher [14]. Möglicherweise ist dies mitbedingt durch Sekretion von sog. Adipokinen und anderen vasoaktiven Substanzen, die auch myokardiale Inflammation und Fibrosierung beeinflussen können [15–18]. Einige dieser Adipokine beeinflussen u. a. die Inflammation und Insulinsensitivität, z. B. Adiponectin, Leptin, TNF alpha, „plasminogen activator inhibitor type 1“, IL-6, IL-8, Omentin und Resistin [19, 20]. Andere werden aufgrund ihres fibrotischen Effekts auch alternativ „Fibrokine“ genannt, z. B. Osteopontin, Activin A und Matrixmetalloproteinase [21]. Eine Reduktion dieser Adipokine oder die Entfernung des Fettgewebes konnte in Studien die Fibrosebildung verringern, die kardiale Funktion verbessern und die Manifestation einer HFpEF aufhalten [22–24].
EAT als kardiales Bindeglied zum metabolischen Syndrom
Kürzlich hat sich gezeigt, dass die Menge von EAT mit einer schlechteren Prognose für Patientinnen und Patienten mit chronischer Herzinsuffizienz verbunden ist [25]. Interessanterweise wird die Menge des EAT bereits durch eine geringe Gewichtsreduktion [26] und durch SGLT2-Hemmer und GLP-1-Rezeptor-Agonisten reduziert [27]. Diese neuen Zusammenhänge zwischen Fettverteilung und Koronarrisiko sowie Herzfunktion könnte ein klinisch relevantes Bindeglied zwischen metabolischem Syndrom, Fettleber/nichtalkoholischer Steatohepatitis (NASH) und erhöhtem kardiovaskulärem Risiko darstellen. Zudem könnte das EAT einen Mechanismus darstellen, der die Beziehung zwischen Übergewicht und früher Kardiomyopathie im Sinne einer HFpEF erklären kann. Ferner muss die Rolle verschiedener weiterer kardialer Fettansammlungen, z. B. peri- und parakardiales Fett sowie perivaskuläres und intrakardiomyozelluläres Fett, weiter untersucht werden.
Fazit
Beim Fettgewebe bzw. Übergewicht und Adipositas geht es nicht allein um die Menge (BMI) oder Funktionalität (Adipositopathie mit alteriertem Adipokinmuster), sondern auch um eine veränderte Verteilung bzw. Ablagerung von Fett.
In Bezug auf das Herz ist das epikardiale Fett (EAT) u. a. mit einem erhöhten Risiko für eine kardiale Dysfunktion und mit einer ungünstigen Prognose bei chronischer Herzinsuffizienz assoziiert.
EAT könnte ein Bindeglied zwischen metabolischem Syndrom und kardialem Risiko darstellen sowie ein weiterer kardialer Mediator für GLP-1-Rezeptor-Agonisten und SGLT2-Hemmer sein.
EAT könnte damit eines Tages zur weiteren klinischen und prognostisch differenzierenden Phänotypisierung der Patientinnen und Patienten beitragen.
Literatur bei den Verfassern
Kontakt-- Prof. Dr. Dirk Müller-Wieland, Medizinische Klinik I, Universitätsklinikum Aachen,

