Das epileptische Herz und seine potenziellen Folgen
Begleiterkrankungen-- Epilepsie und Herzinsuffizienz scheinen auf den ersten Blick wenig miteinander zu tun zu haben. Doch dem ist nicht so. Immer mehr Studien demonstrieren, wie Herzerkrankungen und Epilepsie sich gegenseitig beeinflussen – Grund genug, dieser Konstellation auf den Grund zu gehen.
Veröffentlicht:
Das Herz wird durch zerebrale Erkrankungen beeinflusst.
© erika8213 / Stock.adobe.com
Kardiale Erkrankungen wie Herzinsuffizienz [1] und koronare Herzkrankheit [2] sind bezüglich Prävalenz, Prognose und Lebensqualität eng mit dem Auftreten von Komorbiditäten verknüpft. In diesem Zusammenhang ist in den letzten Jahren die Beziehung von Herz und Hirn in den Fokus gerückt. Die Deutsche Gesellschaft für Kardiologie (DGK) bearbeitet diese Komorbiditäten in einer gemeinsamen Arbeitsgruppe mit der Deutschen Schlaganfallgesellschaft (https://dgk.org/ueber-uns/arbeitsgemeinschaften/arbeitsgemeinschaft-herz-hirn/) und klärt über die Bedeutung und vielfachen Implikationen der Herz-Hirn-Achse auf. Dabei steht die Beziehung von Vorhofflimmern und Schlaganfall im Vordergrund.
Epilepsiepatienten leiden häufig an Herzkrankheiten
Neue Forschungsarbeiten legen nahe, dass neben dem Schlaganfall auch andere zerebrale Erkrankungen mit kardialen Entitäten verknüpft sein könnten. In diesem Zusammenhang wurde jüngst der Begriff des „epileptischen Herzens“ geprägt [3, 4].

Prof. Mark Lüdde Christian-Albrechts-Universität zu Kiel
© Lüdde
Weltweit sind mehr als 50 Millionen Menschen von Epilepsie betroffen [5]. In den Industrieländern liegt die Gesamtprävalenz der Epilepsie zwischen 5 ‰ und 8 ‰ [5]. Die Erkrankung ist durch wiederkehrende Anfälle gekennzeichnet, die auf eine synchrone abnorme oder übermäßige neuronale Aktivität im Gehirn zurückzuführen sind [6]. Epilepsie ist in vielerlei Hinsicht ein ungelöstes Problem. Die Patienten sind nicht nur durch ihre episodischen Anfälle schwer betroffen, sondern auch durch die Behinderungen und die soziale Stigmatisierung, die sie oft begleiten. Aus der Sicht von Public Health hat das Problem enorme medizinische, aber auch soziologische, kulturelle und wirtschaftliche Folgen. Die Inzidenz von Epilepsien zeigt in der Kindheit und im höheren Erwachsenenalter einen Gipfel [6]. Während im Kindesalter oft eine genetische Veranlagung oder genetische Erkrankungen sowie geburtstraumatische Schädigungen ursächlich für das Auftreten von Epilepsien sind, ist bei Erwachsenen die Vielfalt der Ursachen größer: Hier kommen insbesondere Schädigungen des Gehirns in Betracht, z. B. durch Schlaganfälle (ischämisch oder durch eine Hirnblutung), Verletzungen, Tumore, Entzündungen oder als Nebenwirkung von Medikamenten, Drogen- und Alkoholmissbrauch.
Arterielle Hypertonie (aHTN) ist eine nicht zerebrale Komorbidität, die mit dem Auftreten von Epilepsie in Verbindung gebracht wird [7]. Tatsächlich wurden bei 62 % bis 82 % der Epilepsiepatienten kardiovaskuläre Komorbiditäten festgestellt [4]. Die Identifikation kardiovaskulärer Risikofaktoren für das Auftreten einer Epilepsie und der zugrunde liegenden Pathophysiologie könnte auch langfristig die Möglichkeit der Etablierung neuer Therapien der Epilepsie bieten.
Epilepsie könnte Herzinsuffizienz-Entwicklung begünstigen
Der Begriff „epileptisches Herz“ beinhaltet jedoch noch weitere Aspekte, insbesondere auch eine erhöhte Rate kardialer Erkrankungen bei Epilepsiepatienten, die im folgenden erörtert werden sollen. Wir gingen in unserer interdisziplinären Projektgruppe der Frage nach, ob Epilepsiepatienten ein erhöhtes Risiko tragen, im Laufe ihrer Erkrankung eine Herzinsuffizienz zu entwickeln. Mithilfe der IQVIA Disease Analyzer®-Datenbank untersuchten wir retrospektiv eine Kohorte von insgesamt 9.646 ambulanten Patientinnen und Patienten mit Late-Onset-Epilepsie und eine gleich große Kohorte ohne Late-Onset-Epilepsie, die zwischen 2005 und 2018 beobachtet wurden. Epilepsiepatienten wurden individuell 1:1 mit Nichtepilepsiepatienten nach Geschlecht, Alter, Indexjahr, Adipositas, Diabetes, Bluthochdruck, ischämischer Herzkrankheit und jährlicher Konsultationshäufigkeit abgeglichen. Innerhalb von 10 Jahren nach dem Indexdatum wurde bei 28,5 % der Patienten mit Epilepsie und bei 20,5 % der Patienten ohne Epilepsie eine Herzinsuffizienz diagnostiziert (log-rank p < 0,001). In Regressionsanalysen war eine Epilepsie signifikant mit dem Auftreten einer Herzinsuffizienz assoziiert (Hazard Ratio, HR: 1,56; p < 0,001).
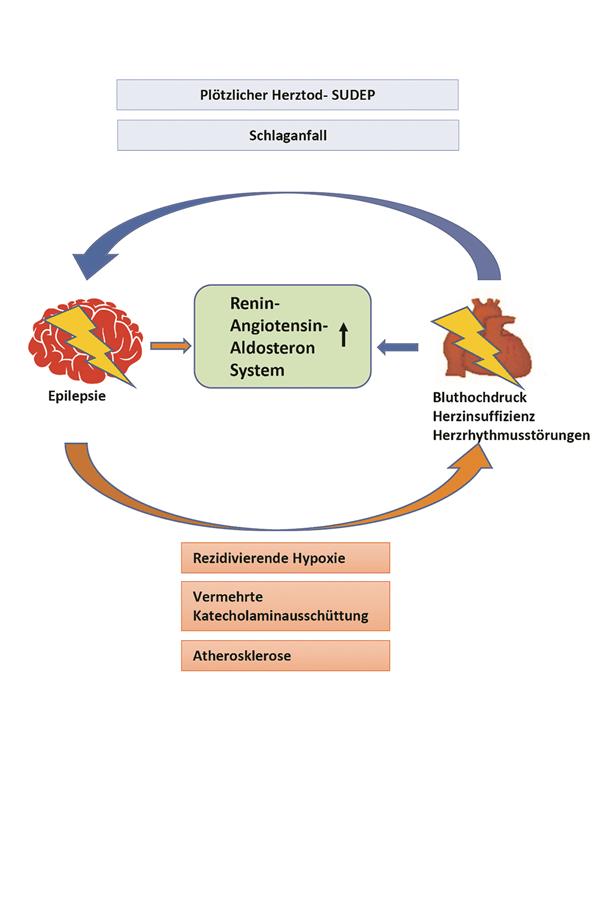
Abb. 1-- Mögliche Interaktionen bei Epilepsie und kardiologischen Erkrankungen.SUDEP = „sudden unexpected death in epilepsy“
© Lüdde
Verschiedene Mechanismen, welche die erhöhte Herzinsuffizienz-Rate bei Epilepsiepatienten erklären könnten, werden diskutiert: So könnte zum Beispiel eine durch (wiederholte) epileptische Anfälle verursachte Hypoxie ein möglicher Mechanismus sein, der eine Herzinsuffizienz auslöst. Es wird vermutet, dass eine mögliche autonome Dysregulation aufgrund einer intermittierenden zerebralen Hypoxie die Verbindung zwischen zerebraler Hypoxie und kardialer Dysfunktion vermittelt [8] (Abb. 1).
In diesem Zusammenhang könnte auch die Takotsubo-Kardiomyopathie – eine stressinduzierte Kardiomyopathie mit typischen morphologischen Merkmalen – die durch eine übermäßige Freisetzung von Katecholaminen und eine pathologische Reaktion des Herzens gekennzeichnet ist, als mögliches Krankheitsmodell dienen.
Bluthochdruck und Epilepsie: Potenzieller neuer Therapieansatz
Durch seine kardiovaskulären Endpunkte wie Schlaganfall, Herzinfarkt und Herzinsuffizienz ist der arterieller Hypertonus (aHTN) einer der wichtigsten Morbiditäts- und Mortalitätsfaktoren in der westlichen Welt. Es wurde kürzlich gezeigt, dass aHTN auch ein Risikofaktor für das Auftreten von Epilepsien ist [7]. In einer Kohorte von 168.612 ambulanten Patientinnen und Patienten mit arteriellem Hypertonus untersuchten wir, ob bestimmte antihypertensive Medikamente mit Klasse-I-Empfehlung zur Behandlung des aHTN das Risiko für die Inzidenz einer Epilepsie verringern können. Patienten, die mit einer der vier blutdrucksenkenden Medikamentenklassen (Betablocker [BB], Angiotensin-Rezeptorblocker [ARB], ACE-Hemmer oder Kalziumkanalblocker [CCB]) behandelt wurden, wurden anhand von Propensity-Scores einander zugeordnet. Am Ende verblieben in jeder Therapieklasse 42.153 Patienten.
Die Inzidenz von Epilepsie innerhalb von fünf Jahren war am niedrigsten bei Patienten, die mit ARB behandelt wurden (0,27 % nach 1 Jahr, 0,63 % nach 3 Jahren, 0,99 % nach 5 Jahren), und am höchsten bei BB- und CCB-Patienten (0,38 % nach 1 Jahr, 0,91/0,93 % nach 3 Jahren, 1,47/1,48 % nach 5 Jahren). Die ARB-Therapie ging mit einer signifikant niedrigeren Inzidenz von Epilepsie einher als die anderen Medikamentenklassen (HR: 0,77; 95%-KI: 0,65–0,90). Beim Vergleich der verschiedenen ARBs zeigte Losartan den deutlichsten präventiven Effekt. Ein möglicher Erklärungsansatz für diese Daten ist, dass das Renin-Angiotensin-Aldosteron-System (RAS) des Gehirns eine besondere Vermittlerrolle bei der Epilepsiepathologie zu spielen scheint und mit der Hyperaktivierung von Ang II/ATR1 und ACE-Signalen in Astrozyten, Oligodendrozyten und Mikroglia verbunden ist [9].
Die Modulation des RAS-Systems bei kardialen Patienten könnte deshalb ein neuer Therapieansatz zur Primärprävention von Epilepsien sein. Zur weiteren Exploration dieses Therapieprinzips müssten prospektive randomisierte Studien folgen. Zum Beispiel wäre die Frage interessant, ob ARBs und insbesondere Losartan ein gegenüber anderen Antihypertensiva bevorzugtes Medikament sein könnte, um bei hypertensiven Patienten nach Schlaganfall die häufige Komplikation Epilepsie zu verhindern.
Was steckt hinter dem unerwarteten Tod bei Epilepsie?
Das Konzept möglicher kardiale Nebenwirkungen einer repetitiven Hypoxie und vermehrter Katecholaminausschüttung als Folge einer Epilepsie legt nahe, dass auch Herzrhythmusstörungen mit Epilepsie assoziiert sein können [4]. Umgekehrt konnten wir kürzlich in einer retrospektiven Studie zeigen, dass Patienten mit Vorhofflimmern ein erhöhtes Risiko für das Neuauftreten einer Epilepsie haben, unabhängig vom Risikofaktor Schlaganfall.
Auch eine Verbindung zwischen Epilepsien und ventrikulären Herzrhythmusstörungen/plötzlichem Herztod wird diskutiert, nicht zuletzt, da die fatale Komplikation eines plötzlichen Todes sowohl bei Epilepsie als auch bei Herzerkrankungen vorkommen kann. Ein erheblicher Anteil der Todesfälle bei Epilepsie treten plötzlich auf. Wenn Trauma, Ertrinken und ein dokumentierter Status epilepticus ausgeschlossen werden und die Autopsie keine anatomische oder toxikologische Todesursache ergibt, werden solche Todesfälle als plötzlicher unerwarteter Tod bei Epilepsie (SUDEP) klassifiziert [10]. Während bei plötzlichem Herztod zumindest teilweise die zugrunde liegende Herzrhythmusstörung dokumentiert werden kann, ist der Pathomechanismus bei SUDEP häufig nicht klar nachvollziehbar. Eine epilepsiegetriggerte Hypoxie wird als ein wichtiger Mechanismus angenommen [10].
Mögliche Herzrhythmusstörungen als Mitursache werden von der Definition des SUDEP prinzipiell ausgeschlossen. Trotzdem ergibt die nicht ausreichende wissenschaftliche Erschließung des Themas zumindest Raum für Spekulationen diesbezüglich. Weitere interdisziplinäre kardiologisch-neurologische Forschungsarbeiten auf diesem Gebiet sind mit Sicherheit wünschenswert [11].
Fazit
Der Begriff des „epileptischen Herzens“ bezieht sich auf potenzielle Verbindungen zwischen zerebralen Erkrankungen wie der Epilepsie und kardialen Entitäten.
Dabei bietet dieses Konzept die Möglichkeit vielfältiger weiterer wissenschaftlicher Arbeiten.
Sowohl Patientinnen und Patienten mit Herzerkrankungen als auch solche mit Epilepsie sind Risikogruppen für einen schweren Krankheitsverlauf und haben ein erhöhtes Sterberisiko.
Die interdisziplinäre kardiologisch-neurologische Behandlung könnte nicht zuletzt auch die Möglichkeit schaffen, diesen Risikogruppen mit innovativen Therapieansätzen in der Zukunft besser zu helfen.
Literatur--
1. McDonagh TA et al. Eur Heart J. 2021; 42(36):3599-26.
2. Sachdev M et al. J Am Coll Cardiol. 2004; 43(4):576-82.
3. Nejm M et al. Epilepsy Behav. 2020;109:107077
4. Verrier RL et al. Epilepsy Behav. 2020;105:106946.
5. Duncan JS et al. Lancet. 2006;367(9516):1087-100.
6. Epilepsia. 1993;34(4):592-96.
7. Gasparini S et al. Neurol Sci. 2019;40(9):1775-83.
8. Blum AS et al. Epilepsia. 2000;41(5):536-541
9. Krasniqi S, Daci A. Int J Mol Sci. 2019;20(3).
10. Nashef L et al. Epilepsia. 2012;53(2):227-33.
11. Verrier RL et al. Epilepsia. 2021;62(8):1780-89.
Kontakt-- Prof. Mark Lüdde, kardiologische Gemeinschaftspraxis Bremerhaven, Christian-Albrechts-Universität zu Kiel

