Komplexe Koronarfisteln: eine seltene Anomalie
Koronaranomalie-- Meist wird die Diagnose einer Koronarfistel zufällig anlässlich einer aus anderen Gründen durchgeführten Koronarangiografie gestellt. Wie viel Bildgebung brauchen wir bis zu ihrer definitiven Diagnose, für die richtige Therapie und das Follow-up?
Veröffentlicht: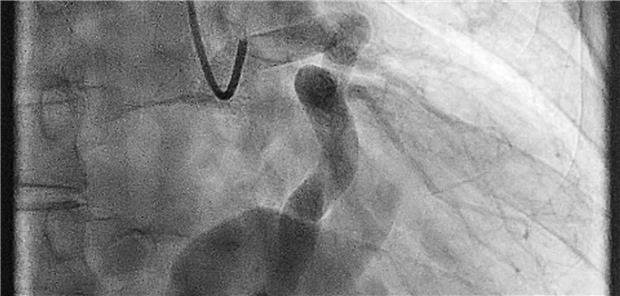
Abb. 1-- Kraniale LAO-Ansicht der deutlich dilatierten LCA. Die dilatierte LCX mündet im Verlauf in eine aneurysmatische Gefäßstruktur. Backes (2)
© Backes
Fallbericht
Ein 46-jähriger Patient wurde uns zur Abklärung einer Episode atypischer pectanginöser Beschwerden vorgestellt. Anamnestisch war bei ihm im Alter von 20 Jahren eine Koronaranomalie festgestellt worden. Eine Fistel drainiere von der linken Koronararterie in den rechten Vorhof. Genauere Angaben oder Bildmaterial waren nicht verfügbar. Der Patient war aktuell beschwerdefrei. Hinweise auf ein akutes Koronarsyndrom lagen nicht vor. Um Klarheit bezüglich der Koronaranatomie zu erlangen und um die Symptomatik des Patienten besser einschätzen zu können, führten wir eine Koronarangiografie durch. Eine stenosierende koronare Herzkrankheit konnte so ausgeschlossen werden. Die linke Koronararterie stellte sich jedoch deutlich dilatiert dar, der Ramus circumflexus (LCX) mündete im Verlauf in eine aneurysmatische Gefäßstruktur (Abb. 1).
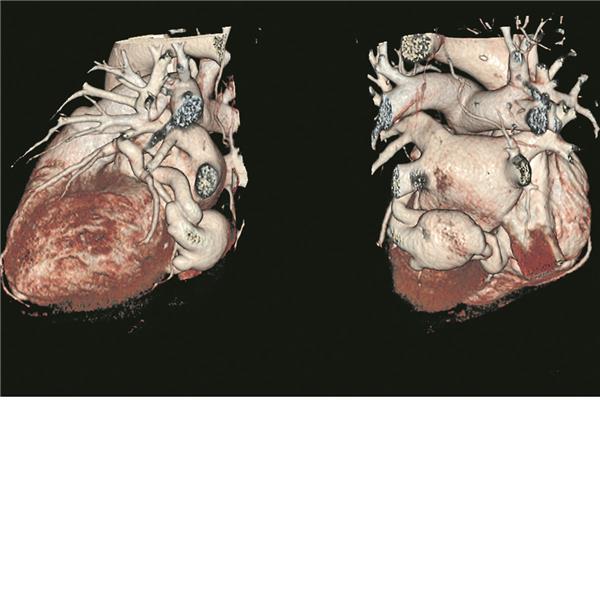
Abb. 2-- 3-D-Rekonstruktion der durchgeführten CT-Schnittbilddiagnostik. Links: Ansicht auf das akzessorische Gefäß der LCX mit Einmündung in das laterale, größere Aneurysma des Koronarsinus. Rechts: posteriore Ansicht auf beide Aneurysmata sowie ihr venöse Verbindung.
© Backes
Hintergrund
Die Prävalenz von Koronarfisteln („coronary artery fistula“, CAF) wird in der Literatur mit < 0,2 % der Gesamtbevölkerung angegeben und stellt damit eine seltene anatomische Variante dar [1, 2]. Meist handelt es sich um eine kongenitale Anomalie. Fisteln können jedoch auch nach herzchirurgischen Eingriffen, Deviceimplantationen, Myokardbiopsien oder nach Thoraxtrauma auftreten. Spontane Okklusionen sind möglich. Die klinische Relevanz von Koronarfisteln liegt in erster Linie im Vorhandensein eines koronaren Stealeffekts, der eine Ischämie und entsprechende Symptome wie Angina pectoris oder Belastungsdyspnoe verursachen kann [1]. Das Ausmaß und die Reihenfolge der Diagnostik sollten hierbei von der Symptomatik des Patienten und deren Akuität bestimmt werden.

Dr. Stephanie Löbig, Ostalb-Klinikum Aalen Löbig
© Löbig
Neben der chirurgischen Okklusion stehen zunehmend auch interventionelle Möglichkeiten zur Verfügung. Doch auch diese Verfahren sind nicht ohne Limitationen verfügbar. So kann es nach Verschluss zum Myokardinfarkt, Embolisationen und Rekonnektion der Fisteln kommen [2]. Insbesondere Fisteln mit Ursprung aus der LCX und Drainage in den Koronarsinus neigen dazu zu dilatieren und sehr groß zu werden. Fisteln mit einer Größe ≥ 10 mm werden z. B. nicht mehr verschlossen, da es zu einer Stase nach Verschluss mit konsekutiver Infarzierung im Versorgungsgebiet des Ursprungsgefäßes kommen kann [5].
Ausblick
Aufgrund der Beschwerdefreiheit unseres Patienten und der vorangegangenen Diagnostik haben wir uns dazu entschieden, den Patienten konservativ zu führen. Wir planen jährliche Follow-up-Untersuchungen, um einen eventuellen Größenprogress der Koronarfisteln und Aneurysmata zu detektieren sowie auch den funktionellen Koronarstatus zu reevaluieren. Aufgrund der nicht eindeutigen Evidenz und der Risiken eines Verschlusses muss in jedem Einzelfall Nutzen und Risiko sorgfältig abgewogen werden. In jedem Fall sind konsequente Follow-ups, die multimodale Bildgebung sowie die interdisziplinäre Diskussion unerlässlich.
Fazit
Koronarfisteln sind seltene Anomalien mit einer Prävalenz von ca. < 0,2 %.
Das Ausmaß und die Reihenfolge der Diagnostik sollten von der Symptomatik des Patienten und deren Akuität bestimmt werden.
Die Entscheidung für einen Verschluss hängt von Symptomen, Shunt-Größe und anderen Faktoren ab, wobei sowohl chirurgische als auch interventionelle Ansätze vorhanden sind.
Kontakt-- Dr. Stephanie Löbig, Ostalb-Klinikum Aalen, stephanie.loebig@kliniken-ostalb.de
Literatur--
1. Buccheri D et al. Heart Lung Circ. 2018;27(8):940-51
2. Al-Hijji M. et al. J Am Coll Cardiol Intv. 2021:14(13):1393-406
3. Qureshi SA. Orphanet J Rare Dis. 2006;1:51
4. Cheung DLC et al. Ann Thorac Surg. 2001;71:190-5
5. Cao H et al. Cardiovasc Eng Technol. 2020;11:394-404

