Leistenpunktion in der Rhythmologie
Troubleshooting Leistenpunktion-- Bei Vorhofflimmern hat sich die Katheterablation als effektive und sichere Methode erwiesen. Ein Nachteil sind jedoch vaskuläre Komplikationen im Leistenbereich. Ist diesbezüglich eine ultraschallgestützte Punktion der „blinden“ vorzuziehen?
Veröffentlicht: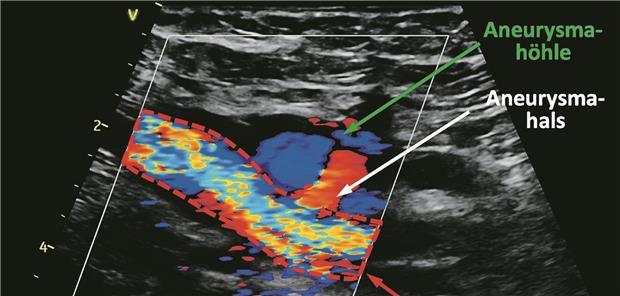
Abb. 1-- Sonografische Darstellung eines Aneurysma spurium (Pseudoaneurysma) der A. femoralis nach akzidentiell transarterieller Lage einer 12-French- Schleuse bei Pulmonalvenenisolation. Unmittelbar durch einen Aneurysmahals mit der A. femoralis verbunden findet sich eine Aneurysmahöhle, die pulsatilen Fluss aufweist. Der Befund ist behandlungswürdig, da sonst die Gefahr einer Größenzunahme der Aneurysmahöhle mit Ruptur besteht.Lawin
© Lawin
Die Pulmonalvenenisolation (PVI) ist die derzeit effektivste Maßnahme zur Reduktion der Arrhythmielast bei Menschen mit Vorhofflimmern [1]. Die Komplikationsrate ist allgemein gering, jedoch machen vaskuläre Komplikationen nach Punktion den größten Anteil aus [2]. Beispielhaft zeigt Abb. 1 ein Aneurysma spurium, ausgehend von der A. femoralis. Einige Studien lassen einen Vorteil der ultraschallgestützten im Vergleich zur „blinden“, anhand topografischer Landmarken durchgeführten Punktion annehmen [3–8], jedoch hat die bisher einzige randomisierte Studie hierzu keinen eindeutigen Vorteil in der Reduktion von Leistenkomplikationen gezeigt [9].
Aktuelle Studie favorisiert ultraschallgestützte Leistenpunktion

Dr. Dennis Lawin--Universitätsklinikum Bielefeld Lawin
© Lawin

Dr. Henrike Hillmann--Medizinische Hochschule Hannover Hillmann
© Hillmann
Number needed to treat: 10
Insgesamt wurden 457 Personen eingeschlossen, von denen 199 ultraschallgestützt punktiert wurden. Bei 11,63 % der konventionellen Punktionen kam es zu vaskulären Komplikationen jeder Art. Die ultraschallgestützt punktierten Patientinnen und Patienten wiesen nur in 2,01 % der Fälle vaskuläre Komplikationen auf (p < 0,0001). Insbesondere wurden auch die Major-Ereignisse (Leistenhämatom mit Interventionsbedarf, arteriovenöse Fistel, Pseudoaneurysma) durch die ultraschallgestützte Punktion reduziert (1,01 vs. 4,26 % nach konventioneller Punktion; p = 0,038). Darüber hinaus hatten Personen, die ultraschallgestützt punktiert wurden, seltener prolongierte Krankenhausaufenthalte (1,01 vs. 5,04 %; p = 0,032). Aus den Daten errechnet sich eine absolute Risikoreduktion von 9,62 % für Leistenkomplikationen jeder Art durch die ultraschallgestützte Punktion [10]. Zur Vermeidung einer Gefäßkomplikation müssen demnach 10 Patienten und Patientinnen mittels Ultraschall punktiert werden (Number needed to treat) [10].
Praktische Aspekte der ultraschallgestützten Punktion der V. femoralis
Das Erlernen der Leistenpunktion in Seldinger-Technik sollte einer der ersten Schritte eines jeden Fellows sein. Die Bildgebung dient als Zusatzinformation zu anatomischen Landmarken. Abb. 2 zeigt beispielhaft eine ultraschallgestützte Punktion der V. femoralis. Vorteile sind die Visualisierung der individuellen Gefäßanatomie und des Gefäßverlaufes. Dies optimiert die mögliche Einstellung der Punktionshöhe und die genaue Visualisierung der Nadel während der Punktion. So kann eine Fehlpunktion oder Verletzung der posterioren Gefäßwand bestmöglich ausgeschlossen sowie anschließend die korrekte Lage von Nadel und Draht nachgewiesen werden [11]. Der lineare Schallkopf wird mit einem sterilen Überzug versehen und in einem Winkel von 90° zum Gefäßverlauf 1–2 cm unterhalb des Leistenbandes (Lig. inguinale) platziert, wobei auf die richtige Ausrichtung des Markers geachtet werden sollte [10]. Alternativ kann die Ausrichtung des Schallkopfes auch längs zum Gefäßverlauf erfolgen. Die Vene liegt an dieser Stelle meist medial der Arterie (Merkspruch: „IVAN: Innen -> Vene -> Arterie -> Nerv“), bevor sie weiter unterhalb hinter der A. femoralis verläuft [11, 12]. Im Vergleich zur Arterie ist sie leichter durch Druck mit dem Schallkopf komprimierbar.
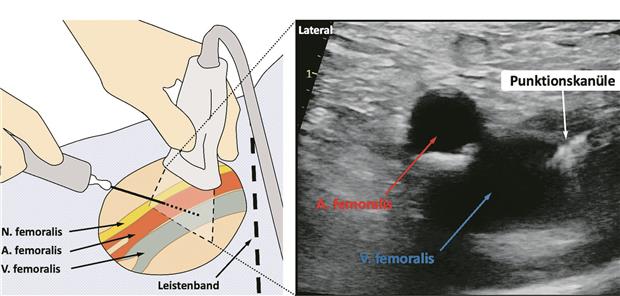
Abb. 2-- Ultraschallgesteuerte Punktion der rechten V. femoralis. Links schematische Visualisierung der Gefäßanatomie der rechten V. femoralis sowie der Position von Schallkopf und Punktionsnadel. Rechts Ultraschallaufnahme unmittelbar während Punktion der V. femoralis. Lawin
© Lawin
Fazit
Die quasi-randomisierte Studie von Kupo et al. (2023) konnte zeigen, dass die ultraschallgestützte Punktion der V. femoralis mit signifikant weniger vaskulären Komplikationen der konventionellen Punktion überlegen ist.
Sollten sich diese Daten bestätigen, dürfte die ultraschallgestützte Leistenpunktion der neue Standard in jedem elektrophysiologischen Labor werden.
Kontakt-- Dr. Dennis Lawin, Universitätsklinik für Kardiologie und internistische Intensivmedizin, Universitätsklinikum OWL der Universität Bielefeld, Campus Klinikum Bielefeld, dennis.lawin@klinikumbielefeld.de
Literatur bei den Verfassern/der Verfasserin
Literatur--
1. Wazni OM et al. N Engl J Med. 2021;384:316-24
2. Hussain SK et al. J Cardiovasc Electrophysiol. 2015;26:527-31
3. Ding WY et al. J Interv Card Electrophysiol. 2023;66:693-700
4. Kupó P et al. J Interv Card Electrophysiol. 2020;59:407-14
5. Sobolev M et al. Europace. 2017;19:850-5
6. Ströker E et al. Europace. 2019;21:434-9
7. Tanaka-Esposito CC et al. J Interv Card Electrophysiol. 20213;37:163-8
8. Wynn GJ et al. J Cardiovasc Electrophysiol. 2014;25:680-5
9. Yamagata K et al. Europace. 2018;20:1107-14
10. Kupo P et al. J Cardiovasc Electrophysiol. 2023;34:1177-82
11. Duncker D et al. Herzschr Elektrophys. 2021;32:274-84
12. Baum PA et al. Radiology. 1989;173:775-7
13. Wiles BM et al. J Interv Card Electrophysiol. 2017;49:3-9

