MAS: seltene Differenzialdiagnose der arteriellen Hypertonie
Seltene Gefäßerkrankung-- Das Middle-Aortic-Syndrom (MAS) ist eine seltene, angeborene Entwicklungsstörung. Es ist durch obstruktive Läsionen der Aorta distal des Isthmus und proximal der Iliacalbifurkation (mittlere Aorta) gekennzeichnet. MAS ist eine wichtige Differenzialdiagnose bei arterieller Hypertonie im Kindes- und Jugendalter.
Veröffentlicht: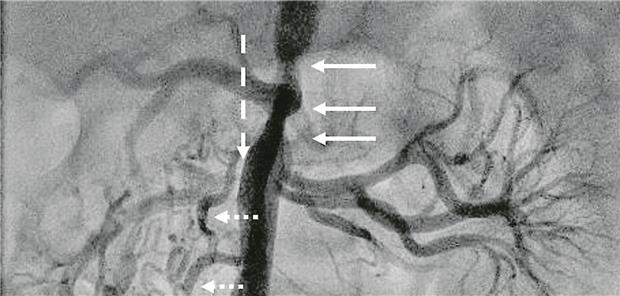
Abb. 1-- (PA); kurzstreckige Hypoplasie der abdominellen Aorta beginnend oberhalb des Truncus coeliacus bis zum Abgang der Nierenarterien (durchgehende Pfeile); Nierenarterienstenose rechts (gestrichelter Pfeil) mit zahlreichen Kollateralen (gepunktete Pfeile); krankheitstypisch: multiple arterielle Nierenversorgung (links).
© Sieverding
Erstmalig 1963 von Sen et al. anhand einer Fallserie mit 16 Patienten beschrieben [1], stellt das Middle-Aortic-Syndrom (MAS) eine zwar seltene, aber wichtige Differenzialdiagnose bei der Abklärung einer arteriellen Hypertonie bei Kindern, Jugendlichen und jungen Erwachsenen dar und macht etwa 0,5–2 % aller Fälle von Stenosen im Bereich der thorakalen oder abdominellen Aorta aus, häufig mit Beteiligung der Nieren- und Mesenterialgefäße. Neben einer schweren Hypertonie können eine Angina abdominalis, eine Claudicatio intermittens oder Kopfschmerzen führende Symptome sein. Bei schwerer Ausprägung besteht ein hohes Risiko für ein progressives Herzversagen, für eine schwere Niereninsuffizienz, eine hypertensive Enzephalopathie oder Schlaganfälle.
Definition und Einteilung
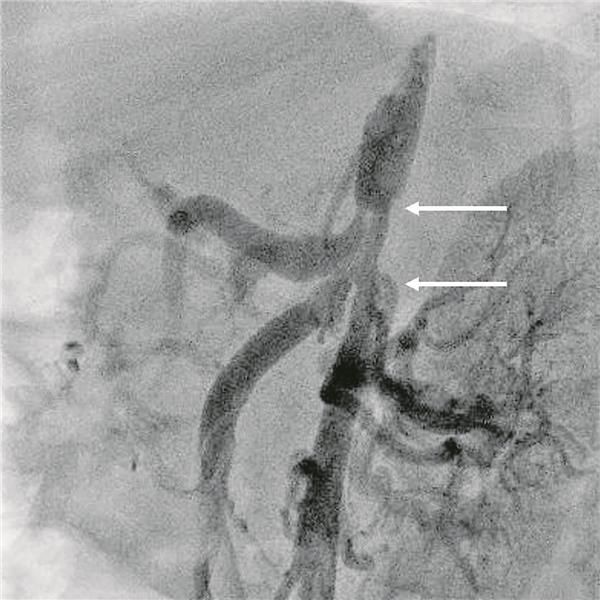
Abb. 2-- (lateral); zusätzliche Stenosen des Truncus coeliacus (oben) und der Arteria mesenterica superior (unten). Sieverding (3)
© Sieverding
Ätiologie
Der überwiegende Anteil wird bisher als idiopathisch oder kongenital bedingt eingeordnet. Zunehmend werden jedoch genetische Ursachen identifiziert. So findet sich ein MAS häufig bei Neurofibromatose Typ 1, Alagille-Syndrom, Williams-Beuren-Syndrom, tuberöser Sklerose und Mucopolysaccharidose Typ I. Mittels Whole-Exom-Sequencing konnte eine monogenetische Ursache bei familiärer MAS nachgewiesen werden (NF1, JAG1, ELN, GATA6, RNF213 [3]).
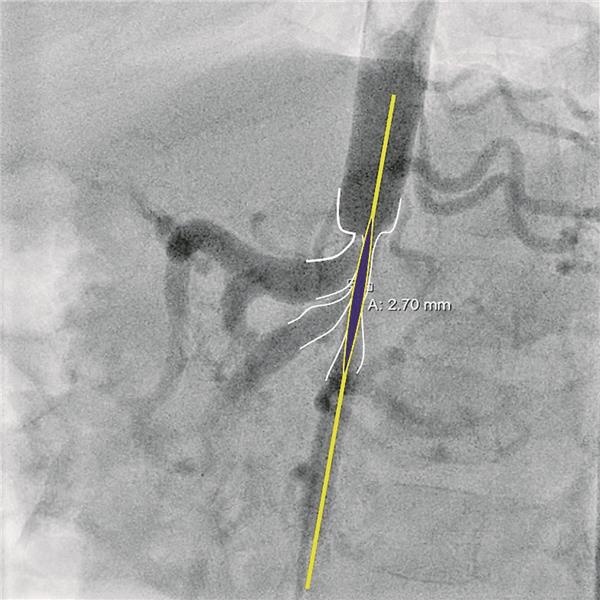
Abb. 3-- (lateral); Durchmesser der abdominellen Aorta 2,7 mm. Eine Stentimplantation bei einer möglichen Dissektion im Rahmen einer Ballonangioplastie würde zwangsläufig zu einem Komplettverschluss des Truncus coeliacus und der Art. mesenterica superior führen.
© Sieverding
Die Diagnose der Takayasu-Arteriitis wird auf Basis des Nachweises einer Arteriitis und nach Ausschluss aller relevanten Differenzialdiagnosen gestellt. Es existieren jedoch keine spezifischen Diagnosekriterien für die Takayasu-Arteriitis, sondern nur Klassifikationskriterien basierend auf die angiografisch nachweisbar befallenen Gefäßabschnitte. Da der Nachweis inflammatorischer Parameter nicht zwingend ist, ist eine Abgrenzung zum idiopathischen oder genetisch bedingten MAS zumindest bei ausschließlich abdomineller Beteiligung schwierig.
Differenzialdiagnose
Die fibromuskuläre Dysplasie (FMD) stellt eine wichtige Differenzialdiagnose zur Takayasu-Arteriitis dar. Die FMD ist eine idiopathische, segmentale, nicht atherosklerotische, nicht inflammatorische Arteriopathie, die durch Veränderungen im Phosphatase und Actin Regulator Gen 1 (PHACTR1) bedingt ist und alle mittelgroßen Gefäße betreffen kann. Am häufigsten sind die Nierenarterien betroffen. Bei etwa 4–5 % der publizierten Fälle eines MAS wird eine FMD als Ursache angegeben, ohne dass dies durch pathohistologische oder angiografische Daten ausreichend belegt wurde. Die fokalen Stenosen beim FMD sind vornehmlich im mittleren oder distalen Gefäßbereich lokalisiert, während die Stenosen beim MAS fast ausschließlich auf das Ostium beschränkt sind.
Diagnostik
Grundsätzlich ist bei Abklärung eines MAS die Erhebung eines Ganzkörpergefäßstatus mittels Sonografie und MR-Angiografie (MRA) oder CT-Angiografie (CTA) erforderlich. Neben der Detektion der Stenosen erlaubt die MRA, gegebenenfalls ergänzt durch eine MR-PET, den Nachweis und eine Beurteilung der Aktivität einer Vaskulitis. Die konventionelle Angiografie bleibt der interventionellen Behandlung vorbehalten.
Therapie
Die Therapie eines MAS ist eine Herausforderung und erfordert eine enge Kooperation von Kindernephrologen, Kinderrheumatologen, Kinderchirurgen und Interventionalisten [4, 5]. Da operative oder interventionelle Maßnahmen im Kindesalter aufgrund des begrenzten „Wachstumspotenzials“ von Prothesen und Stents wenig nachhaltig sind, ist eine effektive Blutdruckkontrolle zunächst das vorrangige Ziel. Mittels einer medikamentösen Kombinationsbehandlung gelingt dies nur in etwa 36 % der Fälle. Zudem liegt analog den Aortenisthmusstenosen eine Erfordernishochdruck vor, bei zu starker Absenkung droht ein akutes Nierenversagen.
Die interventionelle Behandlung mittels Ballonangioplastie und/oder Stentimplantation kann bei zwei Drittel der Patienten zu einer ausreichenden Blutdruckkontrolle führen, wobei die Mehrzahl dieser Patienten weiterhin einer zusätzlichen medikamentösen Therapie bedarf. In der Regel ist eine Behandlung ausschließlich der aortalen Verengung nicht ausreichend und zumindest die Nierenarterienstenosen müssen zusätzlich oder primär angegangen werden. Der Erfolg einer Ballonangioplastie ist auch bei Verwendung von Drug-eluting-Ballons begrenzt. Auch Drug-eluting-Stents verhindern eine Restenosierung nicht sicher bzw. erfordern wachstumsbedingt eine Nachbehandlung. Bei begrenztem Aortendurchmesser und ostialer Lage der Stents ist eine sichere Sondierung des Stentlumens eine Herausforderung, wenn nicht unmöglich. Entsprechend sollte eine interventionelle Behandlung nur ein Baustein im eng abgestimmten Vorgehen sein.
Die chirurgische Therapie umfasst Patchplastiken, Bypassoperationen, Gewebeexpander, Nephrektomien (bei einseitiger Nierenarterienstenose) und Autotransplantationen der Niere(n). Insgesamt wird durch chirurgische Maßnahmen eine Blutdruckkontrolle bei etwa vier Fünftel der Patienten erreicht, auch hier bedarf die Mehrzahl der Patienten weiterhin einer medikamentösen Therapie.
Fazit
Ein Bluthochdruck im Kindesalter erfordert den Ausschluss von Stenosen der thorakalen/abdominellen Aorta und der Nierenarterien.
Bei Nachweis eines MAS und/oder von Nierenarterienstenosen ist die Erhebung eines Ganzkörpergefäßstatus erforderlich.
Vorrangiges Ziel der Behandlung ist die Blutdruckkontrolle und erfordert meist eine Kombination von medikamentösen, interventionellen und chirurgischen Maßnahmen, die „anatomische“ Korrektur ist nachrangig.
Ein Register dieser seltenen Erkrankung erscheint zur Standardisierung der diagnostischen Kriterien und des therapeutischen Vorgehens angezeigt.
Kontakt-- Prof. Dr. Ludger Sieverding, Pädiatrische Kardiologie, Universitätsklinik Tübingen, ludger.sieverding@med.uni-tuebingen.de
Literatur--
1. Sen PK et al. Br Heart J. 1963;25(5):610-8
2. Kim HB et al. Ann Surg. 2018;267:e109-e111
3. Warejko JK et al. Hypertension. 2018;71(4):691-9
4. Rumman RK et al. Am J Hypertens. 2015;28(7):833-46
5. Rumman RK et. Am J Hypertens. 2018;31(6):687-95

