Mit Antikörpern gegen Amyloid-Ablagerungen vorgehen
Systemische Amyloidose-- Die meisten kausalen Therapien zielen darauf ab, die Entstehung von Amyloidablagerungen zu verhindern bzw. den weiteren Krankheitsprozess zu verlangsamen. Aktuelle Studien rücken nun Antikörper zum Amyloid-Abbau, sogenannte „Depleter“, in den Fokus.
Veröffentlicht: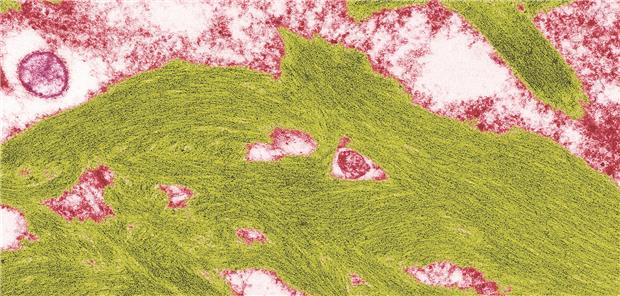
Amyloidose-- Farbige Elektronenmikroskopie eines Gewebeschnitts mit abnormen Amyloid-Ablagerungen (grün). Steve Gschmeissner/Science Photo Library
© Steve Gschmeissner/Science Photo Library

Dr. Fabian aus dem Siepen-- Universitätsklinikum Heidelberg aus dem Siepen
© aus dem Siepen

Prof. Norbert Frey--Universitätsklinikum Heidelberg Frey
© Frey
Bei der ATTR-Amyloidose mit kardialer Beteiligung ist aktuell nur Tafamidis, ein Stabilisator des Transthyretin-Tetramers als kausale Therapie zugelassen [2], sowohl für die hereditäre (ATTRv) als auch für die Wildtyp-Form (ATTRwt). Liegt eine Polyneuropathie bei ATTRv vor, kann auch eine Behandlung mit RNA-Therapeutika erfolgen, zugelassen sind die Substanzen Patisiran [3], Vutrisiran (silencing RNA, siRNA) [4] und Inotersen (Antisense-Oligonukleotid, ASO) [5]. Für Patienten mit kardialer Beteiligung laufen aktuell Phase-III-Studien zur RNA-Therapie (NCT04153149, NCT041 36171).
Phase-I-Studie mit Wirkhinweisen bei ATTR-Amyloidose
![Mit Antikörpern gegen Amyloid-Ablagerungen vorgehen Knochen-Szintigrafie undMRT zeigen Amyloidlast nach„Depleter“-Behandlung (Abb. 1)-- Serielle Szintigrafien (A, B) und mittels T1-Mapping ermitteltes extrazelluläres Volumen in der kardialen MRT (C, D) nach 4 Monaten verblindeter Studienphase und weiteren 8 Monaten Open-label-Phase. In der Verum-Gruppe nahm die Amyloidlast ab, wohingegen in der Placebo-Gruppe keine positiven Veränderungen nachweisbar waren. Nach Wechsel in die Verum-Gruppe nach 4 Monaten zeigten sich 12 Monate nach Studienbeginn bei beiden Patienten Veränderungen.mit freundl. Genehmigung aus [6]Garcia-Pavia P et al. N Engl J Med. 2023;389(3):239-50](/Bilder/Knochen-Szintigrafie-und-MRT-zeigen-Amyloidlast-nach-219305.jpg)
Knochen-Szintigrafie und MRT zeigen Amyloidlast nach „Depleter“-Behandlung (Abb. 1)-- Serielle Szintigrafien (A, B) und mittels T1-Mapping ermitteltes extrazelluläres Volumen in der kardialen MRT (C, D) nach 4 Monaten verblindeter Studienphase und weiteren 8 Monaten Open-label-Phase. In der Verum-Gruppe nahm die Amyloidlast ab, wohingegen in der Placebo-Gruppe keine positiven Veränderungen nachweisbar waren. Nach Wechsel in die Verum-Gruppe nach 4 Monaten zeigten sich 12 Monate nach Studienbeginn bei beiden Patienten Veränderungen.mit freundl. Genehmigung aus [6] Garcia-Pavia P et al. N Engl J Med. 2023;389(3):239-50
© Garcia-Pavia P et al. N Engl J Med. 2023;389(3):239-50
![Mit Antikörpern gegen Amyloid-Ablagerungen vorgehen Knochen-Szintigrafie undMRT zeigen Amyloidlast nach„Depleter“-Behandlung (Abb. 1)--Serielle Szintigrafien (A, B) und mittels T1-Mapping ermitteltes extrazelluläres Volumen in der kardialen MRT (C, D) nach 4 Monaten verblindeter Studienphase und weiteren 8 Monaten Open-label-Phase. In der Verum-Gruppe nahm die Amyloidlast ab, wohingegen in der Placebo-Gruppe keine positiven Veränderungen nachweisbar waren. Nach Wechsel in die Verum-Gruppe nach 4 Monaten zeigten sich 12 Monate nach Studienbeginn bei beiden Patienten Veränderungen.mit freundl. Genehmigung aus [6] Garcia-Pavia P et al. N Engl J Med. 2023;389(3):239-50](/Bilder/Knochen-Szintigrafie-und-MRT-zeigen-Amyloidlast-nach-219306.jpg)
Knochen-Szintigrafie und MRT zeigen Amyloidlast nach „Depleter“-Behandlung (Abb. 1)--Serielle Szintigrafien (A, B) und mittels T1-Mapping ermitteltes extrazelluläres Volumen in der kardialen MRT (C, D) nach 4 Monaten verblindeter Studienphase und weiteren 8 Monaten Open-label-Phase. In der Verum-Gruppe nahm die Amyloidlast ab, wohingegen in der Placebo-Gruppe keine positiven Veränderungen nachweisbar waren. Nach Wechsel in die Verum-Gruppe nach 4 Monaten zeigten sich 12 Monate nach Studienbeginn bei beiden Patienten Veränderungen.mit freundl. Genehmigung aus [6] Garcia-Pavia P et al. N Engl J Med. 2023;389(3):239-50
© Garcia-Pavia P et al. N Engl J Med. 2023;389(3):239-50
Amyloid-Abbau prinzipiell möglich
Trotz aller Limitationen der Studie (kleine Fallzahl, kurze Nachbeobachtungszeit) geben damit vor allem die Befunde der Bildgebung Anlass zur Hoffnung, dass ein Abbau von Amyloid prinzipiell möglich ist. Der resultierende Effekt im Hinblick auf Symptomatik und Prognose kann bisher noch nicht abgeschätzt werden. Zu bedenken ist jedoch, dass Antikörper-Therapien in der Vergangenheit trotz vielversprechender präklinischer Daten sowohl bei der AL- als auch bei der ATTR-Amyloidose auch Rückschläge erlitten haben, wie der vorzeitige Abbruch zweier Studien gegen AL-Amyloid und Serum-Amyloid-P vor mehreren Jahren zeigt. Mit der Zulassung von RNA-Therapeutika für Patienten mit kardialer Beteiligung und kommender Phase-II- und -III-Studien mit verschiedenen Anti-Amyloid-Antikörpern wird sich die Therapielandschaft in naher Zukunft voraussichtlich deutlich verändern und die Behandlungsoptionen erweitern. Auch die Kombination verschiedener Substanzklassen wird noch Gegenstand kommender Untersuchungen sein und könnte ein aussichtsreiches Konzept darstellen.
Fazit
Antikörper gegen Amyloid-Ablagerungen (Depleter) scheinen sowohl bei der Behandlung der AL- als auch der ATTR-Amyloidose eine vielversprechende Substanzklasse zu sein.
Kommende Phase-III-Studien werden Aufschluss über Sicherheit und Effektivität geben.
Auch mögliche Kombinationen mit etablierten Therapien sind noch zu evaluieren.
Kontakt-- Dr. Fabian aus dem Siepen, Medizinische Klinik III, Universitätsklinikum Heidelberg, Fabian.Siepen@med.uni-heidelberg.de
Literatur--
1. Kastritis E et al. N Engl J Med. 2021;385(1):46-58
2. Maurer MS et al. N Engl J Med. 2019;380(2):196-7
3. Adams D et al. N Engl J Med. 2018;379(1):11-21
4. Adams D et al. Amyloid. 2023;30(1):1-9
5. Benson MD et al. N Engl J Med. 2018;379(1):22-31
6. Garcia-Pavia P et al. N Engl J Med. 2023;389(3):239-50

