Neue Scores für die Ablation ventrikulärer Tachykardien
Risikoscores-- Die interventionelle Behandlung ventrikulärer Tachykardien (VT) bei Patienten mit einer strukturellen Herzerkrankung hat sich in den letzten Jahrzehnten zu einem weltweit etablierten Verfahren entwickelt [1]. Eine präzise Risikoabschätzung kann die Sicherheit der Prozedur verbessern.
Veröffentlicht:
Ventrikuläre Tachykardien werden heute abladiert. Neue Scores sollen hier die Sicherheit erhöhen.
© Horacio Selva/stock.adobe.com
Seit den Anfängen der chirurgisch durchgeführten Behandlung ventrikulärer Arrhythmien durch Resektionen großer Vorderwandaneurysmata mit einer postoperativen Mortalität von 15 %, hat die Katheterablation eine bemerkenswerte Evolution erfahren [2]. Durch eine Vielzahl technischer Errungenschaften der letzten Jahre, wie die Implementierung hochauflösender 3-D-Maps der Ventrikel durch moderne Mappingkatheter, gelingt eine bessere Identifikation der pathologischen Areale und eine präzisere Lokalisation der für die Rhythmusstörung verantwortlichen Substrate. Auch durch die Einführung von Anpressdruck-gesteuerten Kathetern konnte ein deutlicher Zugewinn hinsichtlich der intraprozeduralen Sicherheit gewonnen werden. Darüber hinaus ist gerade für die sichere Katheterablation von Hochrisikopatienten neben allen technischen und innovativen Neuerungen die Einordnung der individuellen Komorbiditäten essenziell.
Prädiktive Faktoren für Mortalität
Die Gesamtmortalität nach VT-Ablation wird in einer Analyse von über 9.600 Patienten aktuell mit ca. 1,1 % beziffert [3]. Monozentrische Arbeiten konnten unterschiedliche prädiktive Faktoren hinsichtlich der Mortalität identifizieren. So spielen eine vorbestehende Niereninsuffizienz oder eine zugrunde liegende Herzinsuffizienz eine wichtige Rolle [3, 4].
Auch ist die Sicherheit und Mortalität im Rahmen von VT-Ablationen mit der Pathogenese der zugrunde liegenden Erkrankung assoziiert. Einer fortgeschrittenen strukturellen Herzerkrankung kommt eine besondere Bedeutung zu.
Medikamentöse Therapie rechtzeitig optimieren

Prof. Dr. med. Christian Meyer-- Evangelisches Krankenhaus Düsseldorf
© Meyer

PD Dr. Shibu Mathew-- Universitätsklinikum Essen
© Mathew
Neben der interventionellen Revaskularisierung der Herzkranzgefäße bei einer ischämischen Kardiomyopathie, ist die optimale medikamentöse Therapie einer Herzinsuffizienz jüngst mehr denn je in den Vordergrund gerückt. Hier spielen auch die Implementierung von SGLT2-Hemmern und Angiotensin-Rezeptor-Neprilysin-Inhibitoren in der Therapie eine wichtige Rolle.
Eine manifeste Herzinsuffizienz stellt in diesem Patientenkollektiv nicht selten einen bedeutenden Faktor hinsichtlich der Entstehung und Perpetuierung von VT dar. Dies unterstreicht die Bedeutung der frühzeitigen Optimierung der medikamentösen Therapie.
Hochrisikopatienen vor dem Eingriff identifizieren
Dennoch ist die VT-Ablation bei struktureller Herzerkrankung häufig keine elektive Prozedur, sodass mit nicht optimal vorbehandelten Patienten zu rechnen und eine akute Risiko-Nutzen-Abwägung notwendig ist. Die akute kardiale Dekompensation stellt ein schwerwiegendes Ereignis während invasiver VT-Ablationen bei Patienten mit einer narbenassoziierten VT dar und wird mit bis zu 11 % beziffert. Dies geht mit einer erhöhten Mortalität einher [5].
Eine akute hämodynamische Kompromittierung kann aus den unterschiedlichsten Gründen heraus entstehen: im Rahmen von rezidivierenden Tachykardien während des Eingriffes, bei intraprozeduralen Komplikationen oder generell aufgrund der bestehenden Grunderkrankung. Durch den Einsatz von mechanischen Herzunterstützungsverfahren, wie ECMO, IABP oder pLVAD-Systemen, kann im Einzelfall das Risiko akuter kardialer Dekompensationen minimiert werden [6, 7].
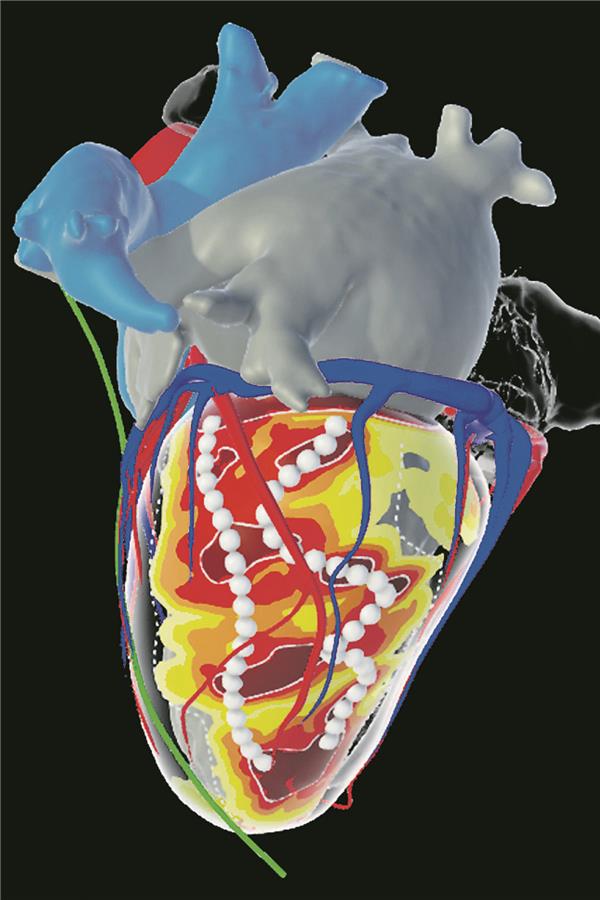
Abb. 1-- Darstellung der Narbe in der präprozeduralen Bildgebung (hier Beispiel eines Post-Infarkt-Patienten). Aus dieser kann das Volumen errechnet werden und in den PAINES2D-Score einfließen. Auf linksventrikulärer Ebene sind die Wandcharakteristika, die zur Identifikation von „kritischen VT-Isthmen“ genutzt werden können, farbkodiert (rot, gelb) dargestellt. Die prospektive Evaluation steht hier aus.
© Meyer
Die Identifikation dieser Hochrisikopatienten und -patientinnen stellt einen bedeutenden Punkt dar. Prädiktive Faktoren einer periprozeduralen, akuten kardialen Dekompensation können ein vorangeschrittenes Patientenalter, eine manifeste Herzinsuffizienz und vorbestehende Komorbiditäten (z. B. Diabetes mellitus oder COPD) sein [5].
Neue Scores für die Risikoabschätzung
Zur Einschätzung des periprozeduralen Risikos und der intrahospitalen Mortalität wurden in den letzten Jahren mehrere Risiko-Scores entwickelt.
Der PAINESD-Score stellt ein sinnvolles Hilfsmittel bei der Risiko-Abschätzung der akuten, periprozeduralen hämodynamischen Dekompensation dar [8, 9]. Ferner kann der Score durch Basisparameter wie pulmonale Erkrankungen, das Alter, die ischämische Kardiomyopathie, die NYHA-Klassifikation, die Ejektionsfraktion, der VT-Sturm und das Vorliegen eines Diabetes mellitus auch hinsichtlich der Vorhersage eines VT-Rezidivs und der Mortalität helfen.
Die Risikoprädiktion kann durch den Parameter des „Narbenvolumens“ mittels des PAINES2D-Score (modifizierter PAINESD-Score; Abb. 1) weiter präzisiert werden [10].
Ein weiterer Score, der in diesem Zusammenhang hilfreich sein kann, ist der RIVA(Risk in VT Ablation)-Score [11]. Mit dieser Risiko-Analyse lässt sich ebenfalls anhand von 5 Basis-Parametern das individuelle Risiko für periprozedurale Komplikationen und die intrahospitale Mortalität abschätzen.
Aktuell erfolgte eine Reevaluation dieses Scores in einem anderen VT-Patientenkollektiv mit der Hinzunahme weiterer Basischarakteristika (mRIVA-Score) [12]. Jedoch ist allen Risikoscores die Notwendigkeit einer prospektiven Reevaluation in größeren Patientenkollektiven gemein.
Fazit
Innovative kathetertechnische Entwicklungen in Kombination mit einem optimalen periprozeduralen Management haben die VT-Ablation weltweit zunehmend als eine Therapie der ersten Wahl etabliert.
Neben der optimalen Vorbereitung und medikamentösen Therapie sollte vor einer Ablation in einem Zentrum mit entsprechender Infrastruktur eine strukturierte Nutzen-Risiko-Evaluation erfolgen.
Kontakt-- PD Dr. Shibu Mathew, Universitätsklinikum Essen, shibu.mathew@uk-essen.de
Literatur--
1. Cronin EM et al. Europace. 2019;21(8):1143-4
2. COUCH OA Jr. Circulation. 1959;20(2):251-3
3. Katz DF et al. Circ Arrhythm Electrophysiol. 2015;8(2):362-70
4. Kuo L et al. JACC Clin Electrophysiol. 2021;7(2):174-86
5. Santangeli P et al. Circ Arrhythm Electrophysiol. 2015;8(1):68-75
6. Bunch TJ et al. Europace. 2012;14(5):709-14
7. Muser D et al. Heart Rhythm. 2018;15(10):1500-6
8. Muser D et al. JACC Clin Electrophysiol. 2019;5(7):801-13
9. Muser D et al. Arrhythm Electrophysiol Rev. 2018;7(4):282-7
10. John LA et al. JACC Clin Electrophysiol. 2023; https://doi.org/10.1016/j.jacep.2023.03.023
11. Mathew S et al. Clin Res Cardiol. 2022;111(5):530-40
12. Doldi F et al. Clin Res Cardiol. 2023; https://doi.org/10.1007/s00392-023-02223-2

