Zirkuläre RNA zur Prävention und Therapie von Kardiotoxizität
Onkokardiologie-- Nicht kodierende RNAs werden klinisch immer bedeutender, als diagnostische und prognostische Biomarker und als „Next Generation“ RNA-Therapeutika. Zirkuläre RNAs sind wegen ihrer hohen Stabilität und Regulationsfähigkeit zellulärer Prozesse interessante Zielstrukturen für neuartige Therapien.
Veröffentlicht: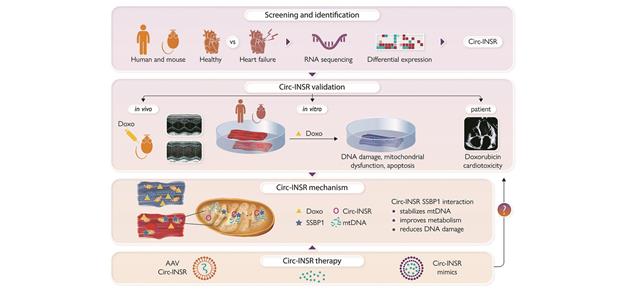
Wirkmechanismen-- Die konservierte zirkuläre RNA Circ-INSR schützt vor Kardiotoxizität, in vitro und in vivo.
© Thum/Bär, aus Lu et al. Eur Heart J. 2022; [3]
Große Fortschritte bei der Entwicklung neuer Krebstherapien sowie die Verfeinerung bestehender Behandlungskonzepte führten in den vergangenen 30 Jahren zu erheblich verbesserten Überlebensraten der Patientinnen und Patienten. Im Gegenzug erhöhte sich jedoch leider auch die Anzahl der Überlebenden, bei denen kardiovaskuläre Komplikationen als Nebenwirkung bestimmter Krebstherapien auftreten.
Diese kardiotoxischen Wirkungen finden sich gehäuft bei Therapien mit Anthrazyklin-Derivaten wie zum Beispiel Doxorubicin. Obwohl Doxorubicin ein sehr potentes Zytostatikum ist und bereits seit den 1970er-Jahren zum Einsatz kommt, ist die klinische Anwendung aufgrund starker kardiotoxischer Nebenwirkungen – sowohl akuter als auch chronischer Natur – limitiert.
Wege aus diesem komplexen Dilemma zu finden, ist die Aufgabe der Onkokardiologie. Dabei geht es neben der Entwicklung von therapeutischen Strategien zur Behandlung von Krebstherapie-induzierter Herzinsuffizienz vorrangig auch um die primäre und sekundäre Prävention kardiotoxischer Nebenwirkungen.
Vielversprechende Studiendaten zu RNA-basierten Therapien

Prof. Dr. Dr. Thomas Thum, Medizinische Hochschule Hannover
© Thum

PD Dr. Christian Bär, Medizinische Hochschule Hannover
© Thum/Bär
Neben den kleinen microRNAs und den langen ncRNAs sind kürzlich auch die sogenannten zirkulären RNAs (circRNAs) in den Fokus der Aufmerksamkeit gerückt. CircRNAs sind kovalent geschlossene, ringförmige RNA-Moleküle, die durch alternative Spleißmechanismen aus prä-mRNA entstehen. Ursprünglich für Spleißartefakte gehalten wird zunehmend klar, dass circRNAs funktionelle Moleküle darstellen [2], deren Funktion im Kontext der Kardiotoxizität jedoch noch nicht näher untersucht worden ist.
Überexpression von Circ-INSR unterdrückt Kardiotoxizität
Um neue circRNAs mit therapeutischem Potenzial zu identifizieren, wurden zunächst mittels neuer Sequenzier- und bioinformatorischer Methoden circRNA-Profile aus murinen und humanen Biopsiematerial von gesunden und insuffizienten Herzen erstellt. Nachfolgende Validierungsexperimente zeigten, dass ein circRNA-Transkript des Insulin-Rezeptor-Genlokus, nachfolgend Circ-INSR genannt, einer starken, mRNA-unabhängigen Regulation unterliegt (s. Abb oben.).
Vor allem durch Doxorubicin verursachter kardiotoxischer Stress führte zum Verlust von Circ-INSR in der Kardiomyozyten-Zellkultur, im Mausmodell und in Biopsiematerial von Doxorubicin-behandelten Menschen, die eine Kardiotoxizität und Herzinsuffizienz entwickelten. Funktionelle Analysen bestätigten, dass die siRNA-vermittelte Inhibition von Circ-INSR die Vulnerabilität von Kardiomyozyten gegenüber kardiotoxischem Stress deutlich erhöht.
Im nächsten Schritt wurde ein adenoassoziierter viraler Gentherapievektor (AAV) für die kardiomyozytenspezifische Überexpression von Circ-INSR generiert. Dessen Applikation unterdrückte die Kardiotoxizität nicht nur in vitro in Ratten- und humanen iPSC-abgeleiteten Kardiomyozyten, sondern auch im Mausmodell der chronischen Kardiotoxizität (kumulative Doxorubicin-Dosis von 25 mg/kgKG über 5 Wochen).
Im Vergleich zur Placebogruppe zeigten die AAV-Circ-INSR behandelten Mäuse in echokardiografischen Untersuchungen einen vollständigen Erhalt der Pumpfunktion des Herzens, was auf histopathologischer Ebene durch einen signifikanten Schutz vor Atrophie und Apoptose der Kardiomyozyten zu erklären war.
Schutz der Mitochondrien vor zytotoxischem Stress
Mechanistisch konnte eine Interaktion von Circ-INSR mit dem „Single Strand Binding Protein 1“ (SSBP1) nachgewiesen werden, die höchstwahrscheinlich für die kardioprotektive Funktion von Circ-INSR verantwortlich ist. SSBP1 ist ein Schlüsselprotein, das entscheidend an der Replikation und der Stabilisierung mitochondrialer DNA beteiligt ist und so zum Schutz der Mitochondrien vor zytotoxischem Stress beiträgt. Dieser Zusammenhang spiegelte sich auch in sogenannten „Seahorse XF-Analysen“ wider, die zeigten, dass die Überexpression von Circ-INSR die Funktion von Mitochondrien schützt.
Zusätzlich zur AAV-vermittelten Überexpression wurde rekombinant hergestelltes, das heißt in vitro transkribiertes und zirkularisiertes Circ-INSR hinsichtlich des Schutzes vor Kardiotoxizität getestet. Hierbei zeigte sich, dass es für die therapeutischen Effekte tatsächlich der zirkulären RNA-Form bedarf, denn die lineare, nicht zirkularisierte Form von Circ-INSR vermittelte keine Schutzfunktion [3].
Fazit
Zirkuläre RNAs sind funktionelle Moleküle und spielen eine wichtige Rolle bei Herzerkrankungen.
Vielversprechende präklinische Daten unterstreichen deren potenziellen Nutzen als „Next Generation“ RNA-Therapeutika.
Literatur--
1. Täubel J et al. Eur Heart J. 2021;42:178-88
2. Santer L et al. Mol Ther. 2019;27:1350-63.
3. Lu D et al. Eur Heart J. 2022; https://doi.org/10.1093/eurheartj/ehac337
Kontakt-- Dr. rer. nat. Christian Bär und Prof. Dr. Dr. med. Thomas Thum, Medizinische Hochschule Hannover;

