Die 2023 ESC-Leitlinie für Kardiomyopathien: Praxistipps
ESC-Guideline-- Die neue Leitlinie der Europäischen Gesellschaft für Kardiologie gibt auf 124 Seiten einen umfassenden Überblick zu Epidemiologie, Charakteristik, Diagnose und Therapie von Kardiomyopathien. Die wichtigsten Neuerungen mit Relevanz für den klinischen Alltag sind hier fokussiert zusammengefasst [1].
Veröffentlicht:![Die 2023 ESC-Leitlinie für Kardiomyopathien: Praxistipps Die ESC-Leitlinie hilft, sich bei Diagnostik und Therapie der Kardiomyopathien zurecht zu finden. [M] alphaspirit/fotolia.com, CN](/Bilder/Die-ESC-Leitlinie-hilft-sich-bei-Diagnostik-und-Therapie-219207.jpg)
Die ESC-Leitlinie hilft, sich bei Diagnostik und Therapie der Kardiomyopathien zurecht zu finden. [M] alphaspirit/fotolia.com, CN
© alphaspirit/fotolia.com
Der Weg zur Diagnose
Verdächtige Symptome, pathologische Zufallsbefunde oder eine familiäre Prädisposition sind typische klinische Szenarien als Basis für die Evaluation einer Kardiomyopathie. Zu Beginn erfolgt stets eine morphologische und funktionelle Charakterisierung zur Erfassung eines initialen Phänotyps, welcher weitere Diagnostik ableitet. Eine multiparametrische systematische Evaluation beinhaltet die Erfassung klinischer Zeichen und Symptome, ein 12-Kanal-EKG sowie Langzeit-EKG und multimodale Bildgebung. Aufgrund der häufigen hereditären Ätiologie wird die Erfassung einer familiären Prädisposition über 3–4 Generationen empfohlen (Klasse-IC-Empfehlung) [1]. Abhängig vom vermuteten Krankheitsbild ist eine Erfassung kardialer Biomarker (hochsensitives Troponin, NT-proBNP) und allgemeiner Indikatoren einer Organdysfunktion (z. B. Kreatinin, Leberenzyme) empfohlen (Klasse-IC-Empfehlung), bei spezifischen Fragestellungen sollte die Diagnostik individuell erweitert werden.
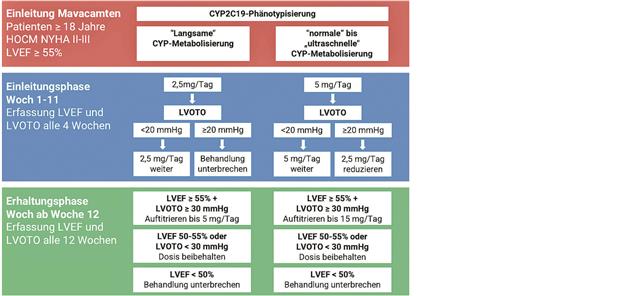
Anwendung von Mavacamten (Abb. 1)-- Die Anwendung von Mavacamten erfordert eine pharmagenetische Bestimmung des Metabolisierungstyps (CYP2C19) sowie regelmäßige Kontrollen der LVOTO und der linksventrikulären Ejektionsfraktion (LVEF). Bei Schwangerschaft darf Mavacamten nicht angewendet werden. Vogel
© Vogel
Endomyokardbiopsie – ja oder nein? Die Endomyokardbiopsie sollte nach sorgfältiger Abwägung des Nutzen-Risiko-Verhältnisses erfolgen, wenn das Ergebnis die Behandlung beeinflussen kann, und nur bei ausreichender technischer Erfahrung durchgeführt werden. Mögliche Szenarien sind Hinweise auf eine myokardiale Inflammation und eine unklare myokardiale Infiltration oder Speichererkrankung (Klasse- IIaC-Empfehlung). Expertise für Kardiomyopathien mit immunhistologischer Aufarbeitung und Elektronenmikroskopie (Speichererkrankungen, Mitochondriopathien) ist unabdingbar für die pathologische Diagnostik [1].
Hypertrophe obstruktive Kardiomyopathie
Die hypertrophe Kardiomyopathie ist definiert als eine linksventrikuläre Wanddicke ≥ 15 mm in mindestens einem Segment, die nicht durch eine Druckbelastung (z. B. hypertensive Herzerkrankung, Aortenklappenstenose) erklärt werden kann, oder 13–14 mm mit weiteren Merkmalen (familiäre Prädisposition, Genetik, EKG-Befunde). Eine transthorakale Echokardiografie mit Erfassung eines intraventrikulären Gradienten in Ruhe und mit Provokation (Valsalva, sitzend/stehend) erfolgt standardmäßig (Klasse-IB-Empfehlung). Die linksventrikuläre Ausflusstrakt-Obstruktion (LVOTO) besteht bei einem Gradienten von ≥ 30 mmHg, eine spezifische Behandlungsindikation besteht in den meisten Fällen bei ≥ 50 mmHg [1]. Betablocker in der maximalen tolerierten Dosis sind die Erstlinientherapie bei symptomatischen Patienten mit einer LVOTO ≥ 50 mmHg (Klasse-IA-Empfehlung). Verapamil oder Diltiazem bilden eine Alternative bei Intoleranz oder Kontraindikation gegen Betablocker. Positiv inotrope Medikamente (z. B. Digoxin/Digitoxin) und arterielle oder venöse Vasodilatatoren (Nitrate, Phosphodiesterase-Inhibitoren) sollten vermieden werden [1].
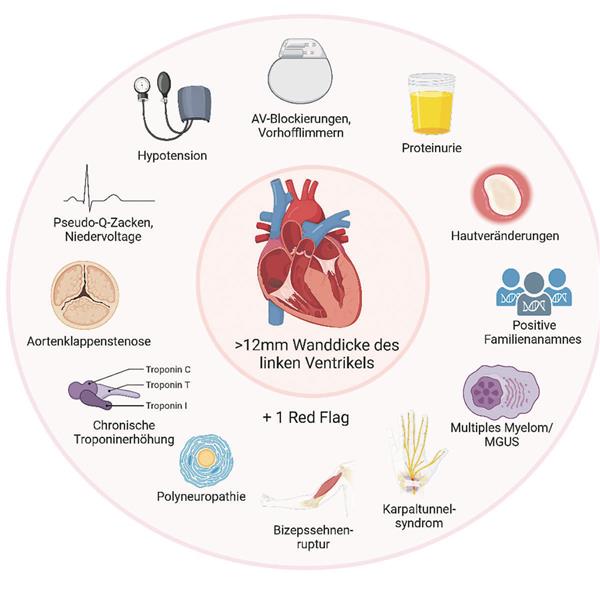
Verdacht auf Amyloidose (Abb. 2)-- Das Vorliegen einer linksventrikulären Hypertrophie sowie mindestens eines weiteren typischen Zeichens oder Symptoms (Red Flag) bilden erste Hinweise auf eine kardiale Amyloidose. Mit BioRender.com erstellt. Vogel
© Vogel
Kardiale Amyloidose
Die kardiale Amyloidose ist eine Erkrankung von hoher klinischer Relevanz und unterschätzter Inzidenz, die durch die abnorme Ablagerung von Amyloidproteinen im Herzmuskelgewebe gekennzeichnet ist. Diese Ablagerungen führen zu einer zunehmenden Steifigkeit des Herzmuskels und beeinträchtigen die Herzfunktion erheblich. Unter den verschiedenen Untergruppen sind die ATTR(Transthyretin-assoziierte)- und AL(Leichtketten-assoziierte)-Amyloidosen die häufigsten. Die Verdachtsdiagnose erfolgt anhand von nicht invasiven Methoden wie der transthorakalen Echokardiografie (TTE), die charakteristischen Befunde wie eine verdickte linke Ventrikelwand (> 12 mm), eine eingeschränkte diastolische Funktion und eine auffällige Myokardstruktur aufzeigt. Liegt zusätzlich noch mindestens ein spezifisches Red Flag vor (s. Liste), sollte eine weiterführende Diagnostik erfolgen [1, 4].
Hinweise auf eine kardiale Amyloidose
linksventrikuläre Hypertrophie (> 12 mm Wanddicke des linken Ventrikels,
PLUS mindestens ein weiteres typisches Zeichen oder Symptom (Red Flag):
AV-Blockierungen, Vorhofflimmern
Proteinurie
Hautveränderungen
positive Familienanamnese
multiples Myelom/MGUS
Karpaltunnelsyndrom
Bizepssehnenruptur
Polyneuropathie
chronische Troponinerhöhung
Aortenklappenstenose
Pseudo-Q-Zacken, Niedervoltage
Hypotension
Hierzu gehören hämatologische Tests wie der Nachweis von Leichtketten oder die Immunfixation in Blut und Urin. Weiterhin sollten nuklearmedizinische Untersuchungen wie die Szintigrafie mit bestimmten Tracern (99mTc-PYP, DPD) erfolgen, um die Diagnose einer Amyloidose stellen zu können. Bei Ausschluss einer monoklonalen Gammopathie und pathologischer Szintigrafie kann die Diagnose ATTR-Amyloidose gestellt werden, eine Myokardbiopsie ist nur bei Hinweisen auf eine mögliche AL-Amyloidose notwendig. In den letzten Jahren hat sich Tafamidis, das zur Therapie der ATTR-Amyloidose seit 2019 in Deutschland zugelassen ist, als vielversprechende Therapieoption etabliert. Dieses Medikament stabilisiert die Tetramere von Transthyretin und verlangsamt so den Krankheitsverlauf, indem die Bildung einer Beta-Faltblatt-Struktur durch Transthyretin-Monomere verhindert wird. Die ATTR-ACT-Studie aus 2018 konnte zeigen, dass die Gesamtsterblichkeit und Hospitalisierungsraten in der Tafamidis Gruppe geringer waren [5]. Mehrere innovative Substanzklassen befinden sich aktuell in klinischer Erprobung, hierunter ATTR-Silencer, spezifische Antikörper und eine Gentherapie mit CRISPR/Cas [6].
Fazit
Kardiomyopathien bilden eine heterogene Gruppe von Erkrankungen, und stellen eine besondere Herausforderung mit Notwendigkeit einer multimodalen diagnostischen und therapeutischen Aufarbeitung dar.
Innovative neue Therapien haben die Behandlung betroffener Patienten schon jetzt entscheidend verbessert, und werden die Grundsätze der Behandlung von Kardiomyopathien in Zukunft tiefgreifend verändern.
Kontakt-- Dr. Lars Michel, Westdeutsches Herz- und Gefäßzentrum, Universitätsklinikum Essen, Lars.Michel@uk-essen.de
Literatur--
1. Arbelo E et al. Eur Heart J. 2023;44(37):3503-626
2. Olivotto I et al. Lancet. 2020;396(10253):759-69; Erratum in: Lancet. 2020;396(10253):758
3. Heitner SB et al. Ann Intern Med. 2019;170(11):741-8
4. Kittleson MM et al. J Am Coll Cardiol. 2023;81(11):1076-126; Erratum in: J Am Coll Cardiol. 2023;81(11):1135
5. Maurer MSN Engl J Med. 2018;379(11):1007-16
6. Gillmore JD et al. N Engl J Med. 2021;385(6):493-502

