ACS ist nicht gleich ACS – die Immunologie unterscheidet sich
Akutes Koronarsyndrom-- Die vorherrschenden Mechanismen, die ein ACS auslösen können, sind zum einen die Ruptur der fibrösen Kappe (RFC) und zum anderen die Erosion an einer intakten Kappe (IFC). Ob sich die klinischen Ergebnisse nach einem RFC-ACS von denen nach einem IFC-ACS unterscheiden und welche Einflussfaktoren hier aktiv werden, wurde im OPTICO-ACS-Studienprogramm untersucht.
Veröffentlicht: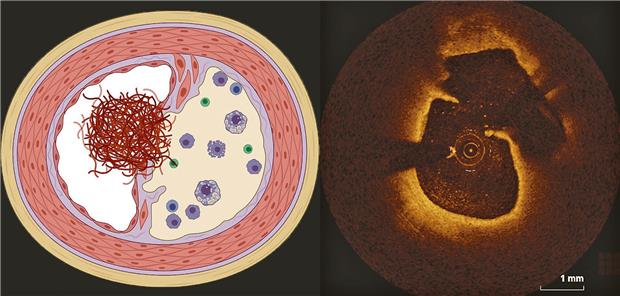
ACS durch Plaque mit rupturierter Kappe (RFC-ACS).
© [M] Kränkel/Leistner
Das klassische pathophysiologische Verständnis zum akuten Koronarsyndrom (ACS) fokussierte auf die Ruptur der fibrösen Kappe über einem atherosklerotischen Koronarplaque (RFC-ACS). Autopsie-Studien ergaben, dass in circa 40 % der Fälle ein ACS infolge des Verlustes der Endothelzellschicht („Erosion“) über einer ansonsten stabilen Koronarplaque mit intakter Kappe (IFC-ACS) entsteht.
RFC-ASC zeichnen sich aus durch Lipidakkumulation, einen großen nekrotischen Kern, Schaumzellen und eine dünne Plaquekappe, IFC-ACS hingegen durch einen kleinen Lipidkern, vaskuläre glatte Muskelzellen (vSMC), proteoglycan- und hyaluronreiche Matrix sowie wenig inflammatorische Zellen (s. Abb.).
Die diesen beiden ACS-Phänotypen zugrunde liegenden zellulären Mechanismen werfen Fragen zum Management von ACS-Patienten auf: Sollten ACS-Patienten je nach ACS-Pathogenese unterschiedlich therapiert werden? Muss ein ACS durch Plaqueerosion überhaupt interventionell per PCI behandelt werden? Wie häufig treten Folgeereignisse auf? Welche diagnostischen Marker wären nutzbar, um eine Prädisposition für ACS infolge von Plaqueruptur (RFC-ACS) von IFC-ACS Fällen zu unterscheiden?
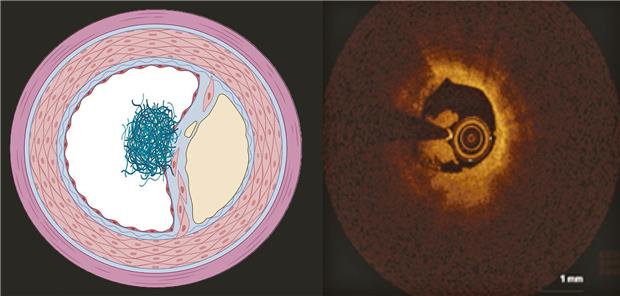
ACS durch Plaque mit intakter Kappe (IFC-ACS).
© [M] Kränkel/Leistner
Das OPTICO-ACS-Studienprogramm hat sich diesem Themenfeld gewidmet und kombiniert mit der optischen Kohärenztomografie ein modernes, hochauflösendes intravaskuläres Bildgebungsverfahren mit der Immunphänotypisierung von lokal im betroffenen Koronargefäß und in der Peripherie entnommenen Blutproben [1]. In der 2020 erschienen Zwischenanalyse konnten bereits Unterschiede in der immunologischen Signatur zwischen beiden Entitäten beschrieben werden, unter anderem die Anreicherung von T-Lymphozyten sowie erhöhte T-Zell-Effektormoleküle im betroffenen Koronargefäß bei IFC-ACS-Patienten im Vergleich zur Plaqueruptur ([1]; Abb.). Die unterschiedliche Rekrutierung der Lymphozyten wurde im Modell nachfolgend mit turbulenten Strömungsverhältnissen assoziiert. Übereinstimmend wurde ein Gefäßverschluss bei Plaqueerosion häufiger nahe einer Gefäßbifurkation beobachtet als bei der Plaqueruptur ([1]; Abb.).
In der Folge wurden weitere Unterschiede im Auftreten eines koronaren Folgeereignisses zwischen beiden Entitäten untersucht, sowie die immunologischen Mechanismen beim IFC-ACS weiter aufgearbeitet [2, 3]. So wurden geringere Raten an unerwünschten Folgeereignissen in Patienten gesehen, deren erstes Ereignis ein ACS mit Plaqueerosion war, im Vergleich zu RFC-ACS-Patienten [2]. Proteomanalysen bestätigten ein geringeres inflammatorisches Proteinspektrum bei Patienten mit Plaqueerosion im Vergleich zu Patienten mit Plaqueruptur. Hier fielen vor allem Interleukin-6 und Proteine im Interleukin-1β-Signalweg auf. Die zirkulierenden Plasmaspiegel von Interleukin-1β sanken vom Ausgangswert direkt nach dem ersten ACS-Ereignis in den folgenden 3 Monaten bei IFC-ACS-Patienten im Gegensatz zur Plaqueruptur [2].
Zudem wurde die Rolle der neutrophilen Granulozyten beim IFC-ACS weiter untersucht [3]: Zentraler Befund dabei war eine verstärkte Aktivierung von Toll-like-Rezeptor 2 (TLR-2) vermittelten Mechanismen in den lokal im betroffenen Koronargefäß vorhandenen Neutrophilen bei IFC-ACS-Patienten vs. RFC-ACS. Stimulierung des TLR-2 führte unter anderem zur vermehrten Ausschüttung von Matrix-Metalloprotease 9, die in Verbindung mit turbulenten Flussbedingungen eine verstärkte Ablösung von Endothelzellen verursachte. Aus dem verschlossenen Koronargefäß extrahierte Thromben von IFC-ACS-Patienten wiesen einen höheren Gehalt an Hyaluronidase-2 auf. Hyaluronidase-2 ist an der Spaltung von hochmolekularer zu niedermolekularer Hyaluronsäure beteiligt, einem Liganden für TLR2. Die Kombination von nicht laminaren Flussbedingungen in der Nähe von Bifurkationen mit der von Neutrophilen freigesetzten Matrix-Metalloprotease 9 könnte daher bei ACS mit Plaqueerosion den Verlust von Endothelzellen fördern und somit zur Initiation der Koronarthrombose beitragen.
Kontakt-- PD Dr. Nicolle Kränkel, Deutsches Herzzentrum der Charité –Berlin, nicolle.kraenkel@dhzc-charite.de; Prof. David M. Leistner, Universitäres Herz- und Gefäßzentrum Frankfurt, David.Leistner@kgu.de
Literatur--
1. Leistner DM et al. Eur Heart J. 2020;41(37):3549-60
2. Gerhardt T et al. Eur Heart J. 2023; https://doi.org/10.1093/eurheartj/ehad334
3. Meteva D et al. Eur Heart J. 2023; https://doi.org/10.1093/eurheartj/ehad379

