Forschung
Neuer Sonderforschungsbereich in Heidelberg
DFG-Förderung in Heidelberg-- Ein neuer Sonderforschungsbereich „Molekulare Schaltkreise von Herzerkrankungen“ soll die Grundlagen für maßgeschneiderte Behandlungen von Herzerkrankungen legen. Dafür werden bestehende und neue Modelle für verschiedene Ursachen von Herzerkrankungen verwendet.
Veröffentlicht:
Forscherinnen und Forscher versuchen, die krankheitsverursachenden molekularen Schaltkreise zu identifizieren.
© Monet / stock.adobe.com

Prof. Johannes Backs, Universitätsklinikum Heidelberg
© Backs
Modelle für Krankheitsursachen
Der SFB 1550 profitiert davon, dass in der modernen Kardiologie die primäre Ätiologie heute mit großer Präzision erfasst werden kann. Erwähnt werden müssen hier die Möglichkeit der Genomsequenzierung aber auch anderer moderner Multi-OMICs-Technologien, die die Ebenen der Epigenetik, des Transkriptoms, des Proteoms und des Metaboloms erfassen. Gleichermaßen wichtig ist die in den letzten Jahren rasante Weiterentwicklung und hohe klinische Relevanz der Krankheitsmodellierung. Heute können in kürzester Zeit krankheitsverursachende humane Mutationen in Tiermodelle eingebracht werden und es werden komplexe metabolische Ursachen nachgeahmt. In humanen, aus induzierten pluripotenten Stammzellen differenzierte Herzmuskelzellen (hiPSC) lassen sich in 2D- und 3D-Modellen Krankheitskausalitäten nachweisen. Damit besitzen die Wissenschaftler in Heidelberg heute für viele verschiedene Ursachen einer Herzerkrankung ein experimentell zugängliches Krankheitsmodell.
Die 18 wissenschaftlichen Teilprojekte wenden diese Kombination zwischen Multi-OMICs-Charakterisierung und Krankheitsmodellierung im SFB 1550 konsequent an und legen den Fokus auf verschiedene Ebenen vom Gen zum Protein und die Interaktionen mit metabolischen Vorgängen (s. Abb.).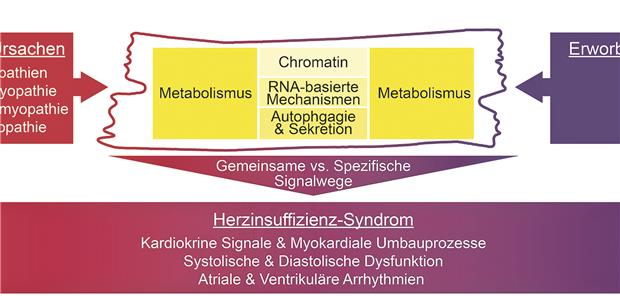
Verschiedene Ursachen, die zur Entstehung des Herzinsuffizienz-Syndroms beitragen: dazu gehören angeborene wie erworbene Faktoren.
© Backs
Wichtige Fragen sind:
1. wie Genmutationen zu einer Umprogrammierung der Herzmuskelzellfunktion führen,
2. wie Stresssignale auf die Herzmuskelzellfunktion und wie deren instruktiven Signale auf andere Zellpopulationen im Herzen wirken,
3. wie Gene und Umwelteinflüsse zusammen wirken, um die Herzmuskelzellfunktion zu regulieren, und
4. was die wichtigsten gemeinsamen Knotenpunkte bei vererbten und erworbenen Herzerkrankungen sind?
Unterstützt werden die wissenschaftlichen Teilprojekte von drei Serviceprojekten. Diese kümmern sich um den Aufbau einer gemeinsamen Infrastruktur für Biobanking, Datenmanagement und Bioinformatik, bieten standardisierte zellbasierte und in-vivo-Krankheitsmodelle sowie phänotypische Techniken zur Analyse von strukturellen und funktionellen Krankheitsparametern an und begleiten die gezielte Ausbildung von Nachwuchswissenschaftler*innen.
Fazit
Die DFG fördert den Sonderforschungsbereich (SFB) 1550 „Molekulare Schaltkreise von Herzerkrankungen“ in den kommenden vier Jahren mit bis zu 14 Millionen Euro.
Die neue SFB soll die Grundlage für maßgeschneiderte Behandlungen von Herzerkrankungen schaffen.
Hinweis-- Weitere Infos: www.crc1550.com
Kontakt-- Prof. Johannes Backs, Sprecher des SFB 1550 und Direktor des Instituts für Experimentelle Kardiologie (Innere Medizin 8) am Universitätsklinikum Heidelberg

