Klinische Stratifikation von HFpEF-Patienten
Patient Profiling-- HFpEF ist ein klinisches Syndrom mit pathophysiologischen Veränderungen am kardiovaskulären System und systemischen Manifestationen in vielen Organen. Die klinischen Zeichen und Symptome müssen individuell erkannt und behandelt werden.
Veröffentlicht:
Die Herzfunktion bei HFpEF wird stark von Komorbiditäten beeinflusst. Victor Habbick Visions/Science Photo Library/mauritius images
© Victor Habbick Visions/Science Photo Library/mauritius images
Es wird angenommen, dass bei HFpEF das Problem in der Peripherie beginnt – nämlich mit den Komorbiditäten – und dies dann Auswirkungen auf die Herzfunktion hat, anders als bei HFrEF, wo das Problem meist direkt im Herzen startet. Letztlich führt in beiden Fällen die resultierende Herzinsuffizienz zur typischen Klinik, mit den Leitsymptomen Dyspnoe und Leistungsschwäche. Allerdings beruhen die klinischen Zeichen und Symptome der HFpEF auf heterogenen pathophysiologischen Phänotypen, die es individuell für den einzelnen Patienten zu erkennen und behandeln gilt. Beispielsweise führt Übergewicht per se zu einem erhöhten Risiko, eine HFpEF zu entwickeln. Auch klagen übergewichtige HFpEF-Patienten häufiger als normalgewichtige über Orthopnoe, stärkere Luftnot bei Belastung oder periphere Ödeme, bei niedrigeren NT-proBNP Werten. Gewichtsreduktion hat sich als gezielte Therapieintervention für adipöse HFpEF-Patienten herausgestellt.
Die derzeitigen pharmakologischen Therapieoptionen für HFpEF sind limitiert [1]. Dass durch die phänotypische Stratifizierung von HFpEF-Patienten individuelle Therapieansätze möglich werden, wurde 2014 in einer Veröffentlichung im European Heart Journal herausgearbeitet [2]. In dieser Publikation wurde auf die Heterogenität des Krankheitsbildes hingewiesen, mit kardiovaskulären (z. B. diastolische Dysfunktion, atriale Dysfunktion, chronotrope Inkompetenz, funktionelle Mitralklappeninsuffizienz, überschießender Blutdruckanstieg unter Belastung) sowie systemischen (z. B. metabolisches Syndrom, Übergewicht, Dekonditionierung, Diabetes, Niereninsuffizienz, chronisch-obstruktive Lungenerkrankung [COPD], Eisenmangel) Komponenten. Nicht alle diese Befunde müssen beim individuellen Patienten auftreten, aber sie erlauben – sofern vorhanden – zusätzliche therapeutische Maßnahmen jenseits der kardiozentrischen Herzinsuffizienztherapie.
Phänotypen bei HFpEF
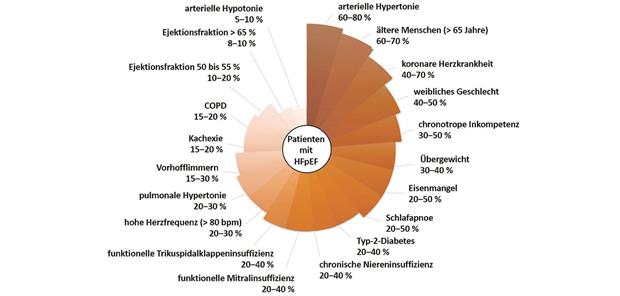
Abb. 1-- Die geschätzte Prävalenz wichtiger Phänotypen der primären HFpEF.
COPD: chronisch obstruktive Lungenerkrankung, CV: kardiovaskulär, FMR: funktionelle Mitralinsuffizienz, HF: Herzinsuffizienz, HFrEF: Herzinsuffizienz mit reduzierter Auswurffraktion, HOCM: hypertrophe obstruktive Kardiomyopathie.
mit freundl. Genehmigung aus Anker SD et al. Eur J Heart Fail. 2023;25:936-55
© Anker SD et al. Eur J Heart Fail. 2023;25:936-55
Körperlich inaktive Patienten mit Dekonditionierung können von einem strukturierten und supervidierten körperlichen Trainingsprogramm profitieren.
Übergewicht ist mit einem erhöhten Risiko für HFpEF assoziiert (obesity related HFpEF), und die pharmakologische Therapie von Adipositas (BMI ≥ 30) mit dem GLP1-Rezeptoragonisten Semaglutid (STEP-HF-Studie) hat neben Gewichtsabnahme positive Effekte auf körperliche Leistungsfähigkeit und Lebensqualität gezeigt.
Schlafapnoe (zentral oder obstruktiv) ist häufig im Kontext der HFpEF und hat negative Effekte auf die Lebensqualität; allerdings gibt es wenige spezifische Daten zur Therapie der Schlafapnoe mit adaptiver Servoventilation (Maskenbeatmung) bei HFpEF. Eine kleinere Studie mit 36 Patienten zeigte vielversprechende Ergebnisse.
Ein Diabetes mellitus (üblicherweise Typ 2) muss natürlich konsequent behandelt werden, ebenso das sehr häufige metabolische Syndrom. Empagliflozin oder Dapagliflozin sollten ohnehin im Therapieplan enthalten sein.
Bluthochdruck ist ein wesentlicher Faktor in der Entstehung und Progression der Herzinsuffizienz. Generell werden auf der Basis der SPRINT-Studie systolische Blutdruckwerte in Ruhe < 130 mmHg empfohlen; dieses Ziel wurde bei HFpEF durch sekundäre Auswertungen aus PARAGON (Sacubitril/Valsartan) und TOPCAT (Spironolacton) bestätigt.
COPD ist mit einem zweifach erhöhten Risiko für das Auftreten von HFpEF assoziiert. Bei HFpEF ist COPD mit einer schlechteren Lebensqualität, höherer Sterblichkeit und vermehrten Herzinsuffizienz-Hospitalisationen verbunden. Allerdings sind die Auswirkungen einer spezifischen COPD-Therapie (z. B. Muskarinrezeptor-Agonisten, Beta-Rezeptor-Agonisten) auf HFpEF nicht gut untersucht.
Chronische Niereninsuffizienz (CKD) ist bei HFpEF sehr häufig, und das Auftreten einer Nierenfunktionseinschränkung ist ein Risikofaktor für das Entstehen einer HFpEF. In der PARAMOUNT-Studie war das Vorhandensein einer relevanten CKD (eGFR zwischen 30 und 60, mit oder ohne Albuminurie) mit stärkeren kardialen Veränderungen verbunden als bei eGFR > 60. Das Risiko für kardiovaskuläre Ereignisse bei HFpEF nimmt mit sinkender eGFR kontinuierlich zu.
Eisenmangel tritt bei über 50 % aller Herzinsuffizienzpatienten auf, ist bei HFpEF häufiger als bei HFrEF und verstärkt die Herzinsuffizienzsymptomatik. Ob eine Eisenmangel-Therapie auch bei HFpEF klinischen Benefit hat, wird aktuell in zwei großen prospektiven Studien untersucht.
Koronare Herzerkrankung (KHK), hier vor allem die mikrovaskuläre Dysfunktion, ist bei HFpEF häufig und stellt ein potenzielles therapeutisches Ziel dar. In selteneren Fällen liegt auch eine koinzidente epikardiale KHK vor, die bei Verdacht abgeklärt und leitliniengerecht behandelt gehört. Bei epikardialer KHK geht HFpEF vermehrt in HFmrEF und HFrEF über.
Vorhofflimmern ist bei HFpEF häufig und verschlechtert die Prognose. Kleinere Studien deuten auf einen potenziellen Benefit durch eine Pulmonalvenenisolation hin. In Deutschland wurde die durch das Deutsche Zentrum für Herz-Kreislauf-Forschung (DZHK) geförderte internationale multizentrische CABA-HFpEF-Studie initiiert, die den Effekt einer Pulmonalvenenisolation auf harte kardiovaskuläre Outcome-Parameter untersucht.
Chronotrope Inkompetenz tritt bei etwa einem Drittel der HFpEF-Patienten auf. Sie hat negativen Einfluss auf die körperliche Leistungsfähigkeit. Allerdings konnte kürzlich eine Schrittmacherstudie mit frequenzadaptiver atrialer Stimulation keinen Benefit zeigen. Zumindest sollte bei chronotroper Inkompetenz die Therapie mit bradykardisierenden Substanzen (in der Regel Betablocker) kritisch geprüft werden.
Funktionelle Mitral- und/oder Trikuspidalklappeninsuffizienz tritt bei HFpEF vermehrt auf und beruht häufig auf einer HFpEF-assoziierten Vorhofdilatation mit konsekutiver Anulusdilatation der AV-Klappen. Der Benefit von katheterbasiertem Repair bei hochgradigen Insuffizienzen bei HFpEF kann auch aufgrund entsprechender erster Studiendaten angenommen werden.
Neben diesen pathophysiologischen Expressionsformen von primärer HFpEF muss stets auch an sekundäre HFpEF-Formen gedacht werden, u. a. kardiale Amyloidose, hypertrophe Kardiomyopathie oder andere Formen spezifischer Kardiomyopathien mit erhaltener LVEF. Für diese Erkrankungen gibt es heute spezifische Therapien, die nur bei entsprechender Diagnose zum Einsatz kommen können.
Fazit
Bei HFpEF lassen sich unterschiedliche Phänotypen diagnostizieren.
Diese ermöglichen zusätzliche, über die kardiozentrierte Herzinsuffizienztherapie hinausgehende Therapieoptionen, die wir unseren Patienten keineswegs vorenthalten sollten.
Kontakt-- Prof. Dr. Burkert Pieske, Deutsches Herzzentrum der Charité Berlin, burkert.pieske@t-online.de; Prof. Dr. Dr. Stephan von Haehling, Universitätsmedizin Göttingen und DZHK, Standort Göttingen, stephan.von.haehling@med.uni-goettingen.de
Literatur--
1. McDonagh TA et al. Eur Heart J. 2021;42:3599-326
2. Senni M et al. Eur Heart J. 2014;35:2797-811
3. Anker SD et al. Eur J Heart Fail. 2023;25:936-55

