Herzinsuffizienz
Interatriale Shunts: tot oder lebendig?
HFrEF und HFpEF-- Wie sieht die Zukunft von interatrialen Shunts zur Herzinsuffizienztherapie aus? Erste Studien dazu verliefen zwar enttäuschend. Das bedeutet aber nicht, dass das Konzept zu Grabe getragen werden muss.
Veröffentlicht: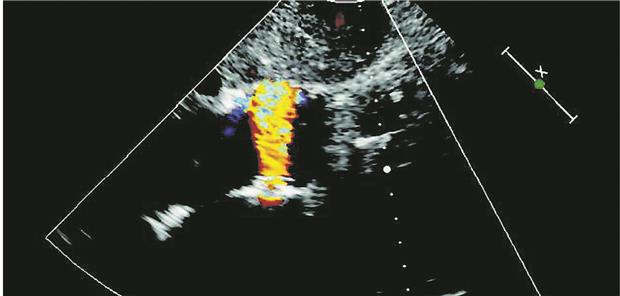
Interatriales Shunt-Device-- Schema des interatrialen Shunts, der eine Verbindung zwischen dem linken und dem rechten Vorhof ermöglicht (links), und Echokardiografie mit Doppler-Farbfluss vom linken zum rechten Vorhof (rechts).
© Hasenfuß G et al. Lancet 2016; 387: 1298–304
Devicebasierte Therapiekonzepte sind in den letzten Jahren als alternative Ansätze zur Behandlung von Patienten mit Herzinsuffizienz entwickelt worden, um strukturelle und biologische Abnormalitäten zu adressieren, die durch pharmakologische Therapien nicht direkt beeinflusst werden können [1]. Eines der aufsehenerregendsten Konzepte auf diesem Feld ist die Schaffung eines iatrogenen Shunts (iASD) auf Vorhofebene [2]. Dieser Shunt hat das Ziel, erhöhte linksatriale Drücke (LAP) zu reduzieren, die aufgrund ihrer zentralen pathophysiologischen und prognostischen Bedeutung für Patienten mit Herzinsuffizienz als attraktives Therapieziel gelten [3–6].

PD Dr. Karl-Philipp Rommel Herzzentrum Leipzig
© Rommel

Prof. Philipp Lurz Herzzentrum Leipzig
© Lurz
Die Vorstellung der neutralen Ergebnisse der ersten Phase-III-Studie auf diesem Gebiet im letzten Jahr führte jedoch zu einer weiterreichenden Diskussion über den Nutzen dieser Therapiestrategie. Einige Experten erklärten das Konzept bereits für „tot“ [7]. In diesem Artikel gehen wir deshalb der Frage nach, ob eine erfolgreiche Wiederbelebung der iASD-Therapie zu erwarten ist.
Prinzip wird weiter erforscht – trotz erster Enttäuschung
Das „InterAtrial Shunt Device“ von Corvia Medical ist das am besten untersuchte System. Es besteht aus einem selbstexpandierbaren Stent, der transfemoral in das interatriale Septum implantiert wird (Tab. 1). Frühe Daten zeigten eine effektive Senkung des LAP und eine gute Sicherheit [2, 8, 9]. Eine Phase-III-Studie (REDUCE-LAP-HF-II), an der 626 Patientinnen und Patienten mit einer Herzinsuffizienz vom HFpEF-Typ (mit erhaltener Ejektionsfraktion) teilnahmen, zeigte jedoch keinen Unterschied zwischen iASD und Shameingriff hinsichtlich des kombinierten Endpunkts und dessen Einzelkomponenten [7]. Präspezifizierte Subgruppenanalysen ergaben, dass Patienten mit niedrigem pulmonalvaskulären Widerstand unter Belastung (PVR < 1,74 WU) und ohne Herzschrittmachertherapie von der Behandlung profitierten [10].
Die zu beobachtenden Kriterien, die für einen Nutzen sprechen, scheinen mechanistisch plausibel, da sie mit einer fortgeschritteneren Rechtsherzdysfunktion in Verbindung gebracht werden können. Ein iASD reduziert den LAP, indem es druckabhängig Blutvolumen vom LA ins rechte Herz leitet und somit den pulmonalen Blutfluss erhöht. Dies kann mittel- und langfristige zur Entwicklung einer Rechtsherzinsuffizienz führen [11, 12].
Interatriales Shunt-Device-- Schema des interatrialen Shunts, der eine Verbindung zwischen dem linken und dem rechten Vorhof ermöglicht (links), und Echokardiografie mit Doppler-Farbfluss vom linken zum rechten Vorhof (rechts).
© Hasenfuß G et al. Lancet 2016; 387: 1298–304
Die primär enttäuschenden Ergebnisse führten daher keinesfalls zu einer Bestattung des Therapieansatzes, sondern innerhalb kürzester Zeit zum Design einer Folgestudie. Die RESPONDER-HF-Studie (NCT05425459) ist eine randomisierte, shamkontrollierte, doppelt verblindete Studie, die eine iASD-Therapie bei HFpEF-Patienten und niedrigem PVR unter Belastung untersucht. Von einem klinischen Standpunkt bleibt abzuwarten, ob die Bestimmung eines Belastungs-PVR skalierbar und vor allem präzise reproduzierbar ist.
Auch für das V-Wave „Ventura Interatrial Shunt System“ (Tab. 1) gibt es positive frühe klinische Daten [13, 14]. Die Rekrutierung der Phase-III-Studie (RELIEVE-HF, NCT03499236) ist bereits beendet. Neben HFpEF-Patienten wurden auch Patienten mit reduzierter Ejektionsfraktion (HFrEF) eingeschlossen. Aktuell ist die RELIEVE-HF-Studie wohl die bedeutendste iASD-Studie. Die Ergebnisse sind für Anfang 2024 antizipiert und können mit Spannung erwartet werden.
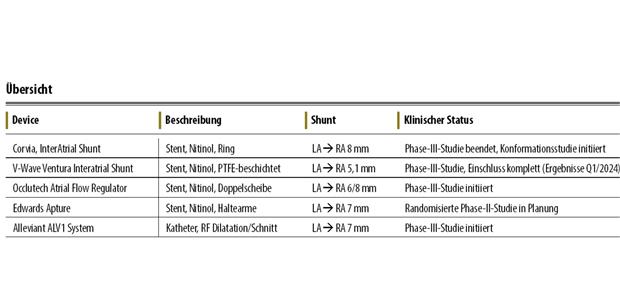
Tab. 1-- Übersicht über die im Text besprochenen Techniken zur linksatrialen Dekompression. Neben den hier genannten stehen weitere Devices zur Verfügung, die sich in frühen Phasen der klinischen Prüfung befinden.
© Rommel/Lurz
Sie ist jedoch bei weitem nicht die einzige Studie. Ein ähnliches Konzept wie zuvor beschrieben verfolgt der „Occlutech Atrial Flow Regulator“ (AFR), der in verschiedenen Shuntgrößen verfügbar ist (Tab. 1) [15–19]. Die FROST-HF-Studie (NCT05136820) ist eine initiierte Phase-III-Studie, die das Device in HFrEF und HFpEF untersucht.
Ein weiteres Konzept besteht in der Schaffung eines Shunts vom LA zum Koronarvenensinus („Apture Transcatheter Shunt System“, Tab. 1) [20]. Dieser Shunt bewahrt potenziell die septale Anatomie und einen physiologischen rechtsatrialen Blutfluss und reduziert das Risiko für paradoxe Embolien oder Rechts-Links-Shunting [20, 21]. Eine randomisierte, shamkontrollierte Phase-II-Studie ist geplant (ALT FLOW II, NCT05686317) [21].
Darüber hinaus wurde ein Ansatz entwickelt, der die Schaffung eines iASD ohne verbleibendes Device ermöglicht. Auf diesen basiert das Alleviant ALV1-System, das einen Shunt mittels Radiofrequenzenergie über einen speziellen Katheter herstellt (Tab. 1) [22]. Der Einschluss in die Phase-III-Studie hat bereits begonnen (ALLAY-HF, NCT 05685303).
Das Konzept lebt weiter
Insgesamt besteht kein Zweifel, dass die iASD-Therapie für Herzinsuffizienzpatienten noch nicht zu Grabe getragen, sondern ganz im Gegenteil sehr lebendig ist. Aktuell stehen eine Vielzahl von Devices und Strategien zur linksatrialen Dekompression zur Verfügung, von denen sich die hier diskutierten bereits in fortgeschrittenen Phasen der klinischen Prüfung befinden, während andere noch in der frühen klinischen Testung sind (z. B. D-shant-Device, NoYA-System, Intershunt).
Aktuelle Studien mit verschiedenen Einschlusskriterien werden es ermöglichen, nicht nur die Effektivität verschiedener Therapieansätze zu vergleichen, sondern auch tiefere Einblicke in physiologische Zusammenhänge zu gewinnen, Prädiktoren für das Therapieansprechen zu identifizieren und die Langzeitsicherheit des Konzepts zu demonstrieren.
Fazit
Erhöhte Drücke im linken Vorhof haben eine zentrale pathophysiologische und prognostische Bedeutung für Patientinnen und Patienten mit Herzinsuffizienz und stellen ein attraktives Therapieziel dar.
Ein iatrogener, druckabhängiger, Links-Rechts-Shunt auf Vorhofebene hat das Potenzial, den linken Vorhof zu entlasten und Herzinsuffizienz-Symptome zu reduzieren.
Verschiedene Verfahren zur Schaffung eines interatrialen Shunts wurden entwickelt und befinden sich in unterschiedlichen Stadien von klinischen Untersuchungen.
Erste randomisierte Daten legen nahe, dass eine umfassende hämodynamische Phänotypisierung notwendig sein wird, um Patienten zu identifizieren, die potenziell von einer interatrialen Shunttherapie profitieren können.
Literatur bei den Verfassern
Kontakt-- PD Dr. Karl-Philipp Rommel, Klinik für Innere Medizin/Kardiologie, Herzzentrum Leipzig

