Pulsed-Field-Ablation: neue Chancen, neue Risiken?
Vorhofflimmern-- Von der Pulsed-Field-Ablation erhofft man sich eine noch sicherere und effektivere Ablationsstrategie für Patientinnen und Patienten mit Vorhofflimmern. Dass sich diese Erwartungen bestätigen könnten, dafür sprechen die ersten Studien. Trotzdem bleiben offene Fragen.
Veröffentlicht: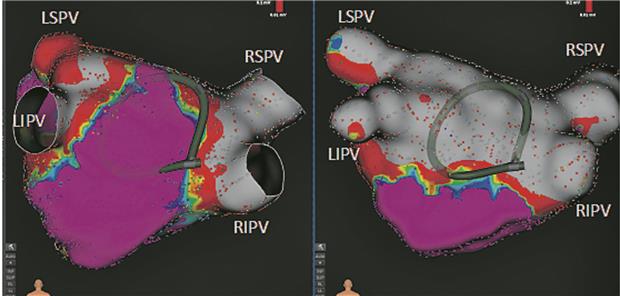
Elektrische Isolation der LA-Hinterwand mit PFA in Nähe des angrenzenden Ösophagus
© Asklepios Klinik St. Georg
Die Pulsed-Field-Ablation (PFA) ist eine neue, nicht thermale Energieform, die ihren Einsatz bei der Katheterablation von Vorhofflimmern (VHF) findet und seit 2021 in Deutschland zur Verfügung steht. Während der Energieabgabe kommt es zum Aufbau eines sehr schnellen elektrischen Feldes, das zu einer Destabilisierung der Myozyten-Zellmembran führt. Es entstehen mikroskopisch kleine Poren, die konsekutiv zum Zelltod führen. Bei diesem Prozess handelt es sich um die sogenannte Elektroporation. Das Besondere hierbei ist, dass für verschiedene Gewebetypen unterschiedliche Nekrose-Schwellenwerte existieren. Das elektrische Feld, das bei der PFA eingesetzt wird, hat einen niedrigeren Nekrose-Schwellenwert für Kardiomyozyten, als für andere Gewebearten – es entsteht eine Selektivität für Herzmuskelgewebe. Der Vorteil ist eine effektive Ablation unter Schonung angrenzender Gewebestrukturen während der Ablation im Vorhof, wie z. B. des Ösophagus oder des N. phrenicus. Dies könnte im Gegensatz zu bisherigen thermalen Energieformen, wie Hochfrequenzstrom oder Kryoenergie, einen Sicherheitsvorteil bei der Katheterablation ermöglichen.
Zum aktuellen Zeitpunkt wurden weltweit bereits über 14.000 Vorhofflimmerpatientinnen und -patienten mit PFA behandelt. Derzeit sind zwei Kathetersysteme/-plattformen in Deutschland CE-zertifiziert und zugelassen.
Evidenz spricht für höhere Isolationsraten bei Vorhofflimmern
In einer im Januar 2023 publizierten Metaanalyse aus 16 PFA-Studien wurde eine akute Pulmonalvenenisolations(PVI)-Rate von 100 % angegeben. Daten bezüglich chronischer Raten isolierter Pulmonalvenen sind noch limitiert. In einer Publikation von Tohoku et al. waren bei 25 Patientinnen und Patienten nach PFA-PVI, die sich mit VHF-/atriale Tachykardie(AT)-Rezidiv zur erneuten Ablation vorstellten, 91 % der Pulmonalvenen isoliert. Die Isolationsrate liegt damit höher, als es bei thermalen Energieformen berichtet wurde. Das große multizentrische „Manifest-PF“-Register (24 Zentren), in dem die initialen Erfahrungen mit der PFA einflossen, ergab eine Vorhofflimmernfreiheit von 86,6 % (paroxysmales VHF) und 73,4 % (persistierendes VHF) im 6-Monats-Follow-up. 1-Jahres-Follow-up-Ergebnisse werden in Kürze erwartet.
Innerhalb kurzer Zeit wurde das Anwendungsgebiet der reinen PFA-geführten PVI im Rahmen von klinischen Studien bereits erweitert.
Neben der Durchführung einer PVI scheint die Substratmodifikation des linken Vorhofs durch Isolation der linksatrialen Hinterwand, die eine Rolle in der Pathogenese des VHF spielen könnte, eine weitere Möglichkeit für PFA – insbesondere aufgrund der Nähe der linksatrialen Hinterwand zur Speiseröhre (Abb. 1). Dass dieser Ansatz durchführbar ist, haben erste Studien belegt. Langzeitdaten zur Effektivität dieser Methode bleiben noch abzuwarten. In postprozedural durchgeführten Endoskopien ließen sich nach der PFA mit dem multipolaren Katheter bislang keine Läsionen im Ösophagus nachweisen.
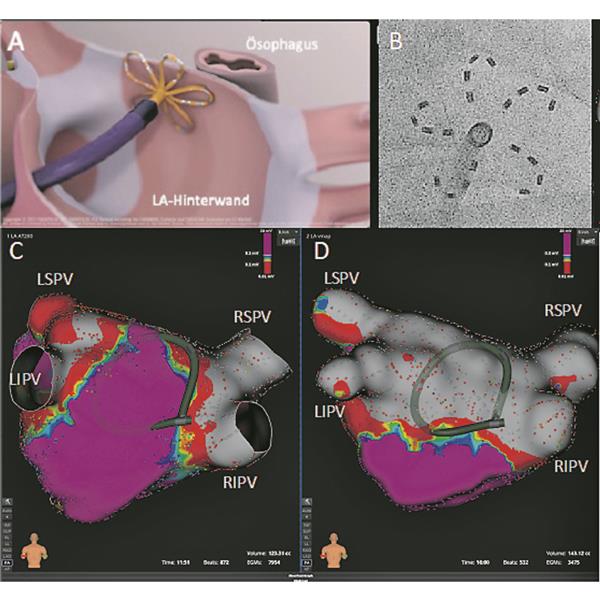
Abb. 1-- Elektrische Isolation der LA-Hinterwand mit PFA in Nähe des angrenzenden Ösophagus. A: Vereinfachte Darstellung des multipolaren PFA-Katheters in „Flower“-Form an LA-Hinterwand (© Farapulse Inc.). B: Fluoroskopie-Darstellung des PFA-Katheters. C+D: 3-D-Voltage-Map des LA vor (C) und nach (D) erfolgreicher Isolation der LA-Hinterwand mit PFA; grau und rot = elektrische Isolation/Narbe, lila = gesundes Vorhofmyokard.
© Asklepios Klinik St. Georg
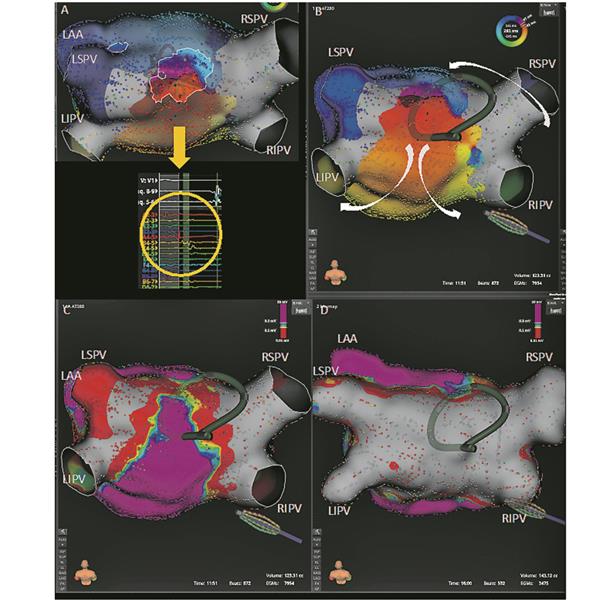
Abb. 2-- Dachabhängige atriale Tachykardie. A: Aktivierungsmap des LA mit Blick auf Vorhofdach; dachabhängiger Makroreentry mit Nachweis des kritischen Isthmus (fraktionierte Potenziale gelber Pfeil) B: PFA-Katheter am Dach (Pfeile = Aktivierung des Makroreentry). Voltagemap vor (C) und nach PFA (D) des Dachs und der Hinterwand. Initiale Niedervoltage im Bereich des Dachs in C. LIPV: links inferiore Pulmonalvene (PV); LSPV: links superiore PV; RSPV, rechts superiore PV; RIPV, rechts inferior PV; grau und rot entspricht der elektrischen Isolation/Narbe, lila zeigt gesundes Vorhofmyokard.
© Asklepios Klinik St. Georg
PFA als alternativer Ansatz für linksatriale Tachykardien
Insbesondere die Behandlung konsekutiver linksatrialer Tachykardien nach initialen VHF-Ablationen, die durch vorherige Ablationslinien oder fortgeschrittene atriale Fibrose entstehen, stellen häufig eine Herausforderung in der interventionellen Elektrophysiologie dar. Neben der Identifikation des zugrunde liegenden Mechanismus kann auch die Anlage und vor allem Blockierung von Ablationslinien schwierig sein.
PFA scheint hier aufgrund der hohen Spezifität und Effektivität der Läsionsbildung eine alternative Lösungsmöglichkeit zu bieten, besonders bei Patientinnen und Patienten, die sich bereits mehrfachen Vorablationen mit anderen Energiequellen unterzogen haben. In einer ersten Studie von Gunawardene et al. konnte die PFA bei 15 Patientinnen und Patienten mit linksatrialer Tachykardie effektiv eingesetzt werden. Circa 60 % der atrialen Tachykardien terminierten nach Identifikation des zugrunde liegenden Mechanismus mit der ersten PFA-Abgabe. Alle durch PFA angelegten Ablationslinien (anteriore Linie, Dachlinie und Mitralisthmuslinie) zeigten sich innerhalb kurzer Durchführungszeit akut blockiert (Abb. 2).
Verfahren scheint sehr sicher zu sein
Bezüglich der Sicherheit von PFA konnte in der großen multizentrischen Registerarbeit „Manifest-PF“ gezeigt werden, dass die aufgetretenen Komplikationen hauptsächlich mit der Durchführung der Katheterablation, nicht aber mit der verwendeten Energiequelle assoziiert sind. Die Rate an schwerwiegenden Komplikationen lag bei 1,6 %, die nicht schwerwiegender bei 3,9 % und ist vergleichbar mit publizierten Daten der Katheterablation.
Eine Ausnahme bildet hier jedoch das Auftreten von transienten Koronarspasmen. In einem 2022 veröffentlichten Fallbericht von Gunawardene et al. kam es bei einem Patienten während der PFA-geführten Anlage einer Mitralisthmuslinie kurz nach der PFA zum Auftreten von ST-Streckenhebungen im EKG. Eine direkt durchgeführte Koronarangiografie zeigte einen Koronarspasmus der A. circumflexa vis-à-vis der endokardialen Ablationsstelle. Unter Gabe von intrakoronarem Nitroglyzerin verschwand der Koronarspasmus. Es folgten daraufhin präklinische und klinische Studien vor allem durch die Arbeitsgruppe um Prof. Vivek Reddy (Mount Sinai, New York). In diesen konnte gezeigt werden, dass unter Verwendung des multipolaren PFA-Katheters keine Koronarspasmen während der PVI oder Isolation der linksatrialen Hinterwand auftreten. Jedoch kam es bei 100 % der Patienten, bei denen eine rechtsatriale Isthmusablation mit PFA durchgeführt wurde, zu einem Spasmus der rechten Koronararterie. Sowohl durch therapeutische als auch prophylaktische Gabe von intravenösem Nitroglyzerin konnten diese(n) Spasmen behandelt bzw. vorgebeugt werden.
In histologischen Aufarbeitungen im Tiermodell von du Pre et al. konnten minimale Koronarveränderungen nach epikardialer PFA nachgewiesen werden, die zu einer intimalen Hyperplasie führten, aber zu keinen klinisch relevanten Stenosen. Andere Autoren (Neven et al.) fanden keine epikardialen Hyperplasien oder Stenosen im Tiermodell. Der Stellenwert dieser Hyperplasien oder deren Auswirkung beim klinischen Einsatz der PFA sind bislang unbekannt.
Zudem muss kritisch betrachtet werden, dass die PFA ein Oberbegriff für viele mögliche Feldcharakteristika ist (Wellenlängen, Spannungsamplitude, Länge des Pulses, Spannungspolarität [monophasisch-biphasisch], Amplitudenpolarität [unipolar-bipolar]) und somit jedes Kathetersystem mit einem unterschiedlichen PFA-Algorithmus arbeitet.
Umschriebene, meist asymptomatische Läsionen der Speiseröhre treten in bis zu 30 % nach Katheterablation mit thermalen Energiequellen auf. Mögliche gefährliche Komplikationen wie die sehr seltene atrioösophageale Fistel enden mit einer Inzidenz von ca. 0,05 % häufig letal.
Bislang wurde weltweit keine Läsion des Ösophagus und keine atrioösophageale Fistel nach PFA-geführter Katheterablation mit dem multipolaren Katheterdesign berichtet, sodass bezüglich des Ösophagus ein hohes Sicherheitsprofil zu bestehen scheint.
Aufgrund der rasanten Entwicklung der PFA-Technologie ist mit der Zulassung zahlreicher weiterer Katheterdesigns und Lösungen zur Integration in 3-D-Mappingsysteme zu rechnen. Ob auch diese Techniken eine hohe Effizienz und ein gutes Sicherheitsprofil aufweisen werden, bleibt abzuwarten.
Fazit
Die PFA bietet eine neue effektive und sichere Energieform für die Behandlung von Patientinnen und Patienten mit Vorhofflimmern.
Auch wenn mit passageren Beeinträchtigungen umliegender Strukturen (z. B. transiente Paresen des N. phrenicus, transiente Koronarspasmen) gerechnet werden muss, erweist sich die Methode nach dem aktuellen Stand bezüglich schwerer Komplikationen als sehr sicher.
Daher ist auch eine mögliche Ausweitung auf bisher nicht gut adressierbare Areale des Vorhofs z. B. zur Substratmodifikation bei persistierendem Vorhofflimmern denkbar.
Literatur bei der Verfasserin/dem Verfasser
Kontakt-- Dr. Melanie Gunawardene, Klinik für Kardiologie und internistische Intensivmedizin, Asklepios Klinik St. Georg, Hamburg,

